Укажите регион, чтобы мы точнее рассчитали условия доставки
Начните вводить название города, страны, индекс, а мы подскажем
Например:
Москва,
Санкт-Петербург,
Новосибирск,
Екатеринбург,
Нижний Новгород,
Краснодар,
Челябинск,
Кемерово,
Тюмень,
Красноярск,
Казань,
Пермь,
Ростов-на-Дону,
Самара,
Омск
Что такое сопроводительная терапия? Зачем она применяется?
Сопроводительная терапия — это те мероприятия, которые профилактируют или уменьшают негативные последствия основного лечения (химиотерапии, таргетной, лучевой терапии).
В медицине есть понятие «полипрагмазия» — это использование одновременно нескольких лекарств. В такой ситуации крайне сложно или даже невозможно учесть все вероятные побочные эффекты и взаимодействия препаратов между собой. Несмотря на то, что сопроводительная терапия добавляет к основной терапии большое количество препаратов, она действительно очень важна. Без нее побочные явления могут:
- привести к жизнеугрожающим состояниям, которые порой не менее опасны, чем основное заболевание;
- ощутимо снизить качество жизни пациента;
- стать причиной отсрочки основного лечения (а это может ухудшать прогноз заболевания).
Если сопроводительную терапию применять грамотно, она не снижает эффективности химиотерапии и лучевой терапии.
Виды сопроводительной терапии
Профилактика и лечение инфекционных осложнений
Часто на фоне лечения онкологического заболевания возникают инфекции, которые требуют контроля и лечения. Профилактика инфекционных заболеваний — это тщательная гигиена больного и всего, что его окружает. Важно выполнять процедуры (постановку катетера, инъекции, обработку ран) в стерильных условиях. Нельзя контактировать с инфекционными больными. Часто бывает необходимо ограничить посещения пациента, а в особых ситуациях — поместить его в стерильный бокс. Особо внимательно нужно ухаживать за центральным венозным катетером.
Если инфекция уже развилась, лечение может включать антибактериальные, противогрибковые, противовирусные препараты. Все они тоже имеют побочные эффекты, однако обойтись без этих лекарств в онкогематологии не получится: без лечения инфекционные осложнения очень опасны. Дозировки препаратов всегда подбираются в соответствии с возрастом. Это позволяет и побороть инфекцию, и снизить вероятность побочных явлений.
Коррекция панцитопении
Панцитопения — снижение количества клеток крови — требует тщательного наблюдения.
Анемию (снижение гемоглобина) тяжелой степени лечат переливанием эритроцитов крови донора. Как и любое переливание компонентов крови, эта процедура возможна только в стационаре. В редких случаях назначают терапию препаратами железа или стимулятором созревания эритроцитов (эритропоэтином).
Если снижается уровень тромбоцитов крови, для профилактики кровотечений нужно уменьшить риски любого травмирования кожи или слизистых: использовать мягкую щетку для чистки зубов или просто полоскать рот, разумно ограничивать активность, не давать острые столовые приборы маленьким детям. Если возникло небольшое кровотечение, его возможно остановить при помощи перевязки, гемостатической губки, холода. Но даже маленькое повреждение у онкологического пациента может стать причиной для переливания донорских тромбоцитов и свежезамороженной плазмы крови (в ней содержатся факторы, помогающие крови сворачиваться).
Если развивается нейтропения (снижение количества нейтрофилов — клеток, отвечающих за иммунитет), могут назначить терапию колониестимулирующими факторами. Эти препараты «подстегивают» клетки крови (в том числе нейтрофилы) выходить из костного мозга в кровь, чтобы выполнять свои функции.
Особенно опасна фебрильная нейтропения — повышение температуры одновременно со снижением уровня нейтрофилов. В такой ситуации назначают антибактериальные и противогрибковые препараты, которые помогают организму бороться с инфекцией.
Мукозит
Профилактика образования язвочек на слизистой рта и желудочно-кишечного тракта — это бережная гигиена полости рта, употребление мягкой пищи, достаточное питье. Можно рассасывать кубики льда, чтобы охладить слизистую и замедлить развитие мукозита.
Если язвочки уже образовались, может потребоваться обезболивание. Кроме того, пациенту назначают частое полоскание рта растворами с антисептиком. Если необходимо, подключают антибактериальное и противогрибковое лечение. Важно соблюдать диету, в которой не будет веществ, раздражающих слизистую желудочно-кишечного тракта.
Если мукозит тяжелый, пациенту становится больно жевать и глотать. В таком случае рассматривают питание через желудочный зонд и/или парентеральное питание (введение питательных веществ в виде раствора в вену).
Облегчение боли
Чтобы облегчить боль, существует много препаратов и методов терапии. Болезненные процедуры в детской практике сведены к минимуму. Например, лекарства вводят внутривенно (в катетер), а не внутримышечно. Если нужна биопсия, костномозговая или люмбальная пункция, обязательно используют местную (например, лидокаин) или общую анестезию (наркоз).
Для уменьшения боли могут использоваться:
- нестероидные противовоспалительные средства (ибупрофен, целекоксиб);
- парацетамол;
- глюкокортикоиды (дексаметазон);
- опиоидные препараты (морфин,трамадол, фентанил) при выраженной боли.
Существует особый вид боли — нейропатическая. Если врач диагностирует ее, для лечения применяют габапентин, морфин, амитриптилин.
Бывает, что боль длительная и трудно поддается терапии. Тогда возможно применение нейродеструктивных техник. С их помощью разрушают нервные волокна, которые находятся рядом с источником боли. К таким техникам относятся термическая, химическая, холодовая деструкция. Кроме того, используют регионарные методы анестезии (спинальную или эпидуральную). Например, при эпидуральной анестезии обезболивающие лекарства вводят в пространство, окружающее спинной мозг.
Также для лечения болевого синдрома применяют психотерапевтические методы.
Препараты, уменьшающие тошноту
Их назначают по отдельности или в комбинации. Если вероятность развития тошноты высокая, препараты вводят еще до начала лечения. К противорвотным препаратам относятся ондансетрон, дексаметазон, гранисетрон, метоклопрамид, апрепитант. Они могут полностью профилактировать или облегчить тошноту при химиотерапии, иммунотерапии или лучевой терапии.
Уменьшение негативного влияния на почки и печень
При некоторых онкозаболеваниях в начале лечения происходит настолько стремительное разрушение опухолевых клеток, что организм может не справиться с выведением продуктов их распада. Для профилактики синдрома острого лизиса (разрушения) опухоли пациенту вводят внутривенно большие объемы растворов в комбинации с мочегонными. Также применяют аллопуринол или расбуриказу — эти препараты снижают уровень мочевой кислоты, опасной для почек. В редких случаях даже с применением этих мер предосторожности почки могут быть повреждены. Тогда пациенту назначают диализ — метод «очищения» крови при почечной недостаточности.
При терапии циклофосфамидом и ифосфамидом назначают препарат месна, который защищает мочевой пузырь от повреждения.
Выводы
- Сопроводительная терапия нужна, чтобы профилактировать и лечить нежелательные явления, которые возникают в процессе терапии рака.
- Без использования сопроводительной терапии лечение детских онкозаболеваний практически невозможно: многие осложнения основного лечения очень опасны.
- Паузы в терапии основного заболевания могут ухудшить прогноз. Поэтому чтобы не задерживать начало очередного цикла лечения, не стоит ждать, пока побочные эффекты пройдут самостоятельно.
- Сопроводительная терапия не снижает эффективность химиотерапии и лучевой терапии.
Что еще почитать?
- Осложнения химиотерапии (статья OncoWiki).
- Терапия побочных явлений в детской онкологии (на английском языке).
Врач-детский онколог ДГМ КСЦ ВМТ (Детская городская больница №1), Санкт-Петербург
17 ноября 2022
Сопроводительная терапия при проведении полихимиотерапии колоректального рака
Статьи
Опубликовано в: ОНКОЛОГИЯ. ЖУРНАЛ им. П.А. ГЕРЦЕНА, 1, 2016
doi: 10.17116/onkolog20165142-46
О.М. Конопацкова1, С.В. Аверьянова2
1ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, Саратов, Россия;
2НУЗ «Дорожная клиническая больница на станции Саратов-II» ОАО РЖД, Саратов, Россия
Цель исследования — оценка влияния на эффективность лечения колоректального рака включения в схему терапии препарата ремаксол.
Материал и методы. Проведен анализ данных 145 больных колоректальным раком (КРР) Т4 с метастазами и без. Полихимиотерапию (ПХТ) проводили по двум схемам: FOLFOX — у 51 больного из 1-й группы и у 34 — из 2-й, и FOLFIRI — у 32 и 28 больных соответственно. Повторные курсы через 2 нед. По обеим схемам проведено от 6 до 12 курсов. Больные без метастазов в печени первым этапом получили оперативное лечение, при наличии метастазов операции не проводили. В 1-ю (основную) группу были включены 83 больных, получивших препарат ремаксол внутривенно медленно, по 400 мл 1 раз в сутки, по 4 введения после каждого курса ПХТ. Во 2-й группе (сравнения) 62 больных получили стандартную терапию сопровождения. Больные были обследованы соответственно принятым стандартам, в динамике наблюдения исследовали показатели печеночной активности и качество жизни больных.
Результаты. Выявлено, что эффективность терапии больных КРР Т4 с метастазами и без при включении в схему препарата ремаксол повышается за счет снижения гепатотоксичности проводимой ПХТ, проявляющееся более быстрым и выраженным купированием показателей печеночной активности. Улучшение качества жизни больных за счет повышения показателей физической, психической и социальной активности в большей степени отмечено у больных, перенесших органосохраняющие операции.
Заключение. Полученные результаты позволяют предложить включить ремаксол в качестве препарата сопроводительной терапии при проведении химиотерапевтического лечения у больных КРР.
Ключевые слова: сопроводительная терапия, колоректальный рак, полихимиотерапия, ремаксол.
Adjunct therapy during combination chemotherapy for colorectal cancer
O.M. Konopatskova1, S.V. Averyanova2
1Saratov State Medical University named after V. I. Razumovsky, 410012, Saratov, ul. Most Cossack, 112, Russia;
2«Road Clinical Hospital at the station Saratov-II JSC «Russian Railways», Saratov-II station of JSC» Russian Railways, 410004, Saratov, 1st Station Passage, 7.
The objective of the study was to assess the impact on the efficacy of the treatment of colorectal cancer included in the scheme of drug therapy Remaxol. The analysis of the data of 145 patients with colorectal cancer metastases T4 and without. Chemotherapy was conducted in two schemes: FOLFOX — in 51 patients in the first group and 34 — of the second and FOLFIRI — in 32 and 28 patients respectively. Repeated courses of 2 weeks. In both schemes conducted from 6 to 12 courses. Patients without liver metastasis in the first stage of the treatment received surgery in the presence of metastasis — the operation is not carried out. The study group included 83 patients who received the drug Remaxol — intravenously, slowly, 400 ml, 1 time per day, for the introduction of 4 after each course of chemotherapy. In the control group 62 patients received standard therapy support. The patients were examined according to the accepted standards, in addition to observing the dynamics of the investigated parameters of hepatic activity and quality of life. It was found that the effectiveness of treatment of patients with colorectal cancer metastases T 4 and free for inclusion in the scheme of the drug remaxol increased by reducing the liver toxicity of chemotherapy conducted manifested faster and more pronounced cupping indicators of hepatic activity. Improving the quality of life of patients by improving the performance of physical, mental and social activity to a greater extent — in patients who have undergone organ-operation. The results allow us to offer turn Remaxol as a preparation accompanying therapy during chemotherapy in patients with colorectal cancer.
Keywords: supporting therapy, colorectal cancer, chemotherapy, Remaxol.
Колоректальный рак (КРР) является широко распространенной в мире патологией, ежегодная заболеваемость достигает 1 млн случаев, а ежегодная смертность превышает 500 000. По прогнозам, абсолютное число случаев КРР в мире в следующие два десятилетия увеличится в результате роста населения в целом и его старения как в развитых, так и в развивающихся странах [1].
Данная патология требует назначения комплексного, многоэтапного и длительного лечения. Хотя успехи современной химиотерапии позволили добиться излечения многих злокачественных заболеваний, считавшихся ранее фатальными, однако негативной стороной полихимиотерапии (ПХТ) являются побочные эффекты цитостатиков, обусловленные низкой селективностью большинства препаратов. В связи с этим актуальным является назначение сопроводительной терапии, необходимой для улучшения качества жизни онкологических больных [2].
Одним из направлений терапии сопровождения является коррекция возникающей при лечении гепатотоксичности. Профилактика и патогенетическая фармакотерапия поражений печени опираются на препараты с механизмом действия, направленным на устранение одного или нескольких звеньев цепи патогенеза. К таким препаратам относится ремаксол (ООО «НТФФ «ПОЛИСАН», Санкт-Петербург), рекомендованный к применению при нарушении функциональной активности печени, оказывающий антитоксическое, антихолестатическое и антицитолитическое действие. Активные компоненты в составе ремаксола: янтарная кислота, N-метилглюкамин (меглюмин), рибоксин, метионин, никотинамид. Основным показанием к применению ремаксола является лечение заболеваний, сопровождающихся поражением печени, а также интоксикаций организма различной степени тяжести. При применении препарата не меняются реологические свойства крови, нормализуются показатели, характеризующие степень поражения гепатоцитов и функциональное состояние печени [3]. В эксперименте было показано, что добавление препарата в схему лечения цисплатином меланомы В16 способствовало усилению противоопухолевого действия цитостатика [4]. Кроме того, было установлено, что применение ремаксола на фоне циклофосфана повышало уровень восстановленного глутатиона, сохраняло концентрации сульфгидрильных групп белков в ткани печени на уровне интактных животных; способствовало поддержанию энергетических субстратов гепатоцитов (за счет сохранения активности глюкозо-6-фосфатдегидрогеназы), предупреждая оксидативное повреждение глутатионредуктазы и глутатион-S-трансферазы. Помимо описанных выше свойств было установлено, что препарат оказывает мягкое антидепрессивное и антиастеническое действие, но эти исследования требуют более детального изучения [5].
Цель исследования — оценить клиническую эффективность ремаксола при проведении полихимиотерапии у больных колоректальным раком.
Материал и методы
В исследование включили 145 больных с КРР с преимущественным (74,6%) расположением в прямой кишке. Больные были сопоставимы по возрасту, стадии заболевания и схемам ПХТ. Средний возраст составил 62,9±8,5 года (48,9%). В 1-ю (основную) группу вошли 83 больных, из них у 42 был диагностирован КРР Т4 без метастазов, у 41 — с метастазами в печени. Во 2-ю группу (контрольную) были включены 62 пациента с аналогичным диагнозом, из них у 25 метастазы выявлены не были, у 37 диагностированы метастазы в печени. Больным без метастазов в печени первым этапом проводили оперативное лечение, при наличии метастазов операции не проводили. Астеновегетативный (слабость, утомляемость, нарушение сна) синдром являлся ведущим и имел место у 104 (71,7%) больных.
ПХТ проводили по двум схемам: FOLFOX (оксалиплатин 85 мг/м2, 2-часовая внутривенная инфузия в 1-й день; лейковарин 400 мг/м2, 2-часовая внутривенная инфузия в 1-й и 2-й дни; фторурацил 400 мг/м2 внутривенно струйно, затем 600 мг/м2, 22-часовая внутривенная инфузия в 1-й и 2-й дни) — у 51 больного из 1-й группы и у 34 из 2-й; и FOLFIRI (иринотекан 180 мг/м2 внутривенно капельно в 1-й день; лейковарин 200 мг/м2 внутривенно в 1-й день; фторурацил 400 мг/м2 струйно в 1-й день, затем фторурацил 2,4—3,0 г/м2, 24-часовая внутривенная инфузия) — у 32 и 28 больным соответственно. Повторные курсы через 2 нед. По обеим схемам проведено от 6 до 12 курсов.
Кроме того, в 1-й группе после каждого курса ПХТ проводили терапию препаратом ремаксол: внутривенно медленно по 400 мл 1 раз в сутки, не менее 4 введений. Во 2-й группе использовали стандартную терапию: внутривенно глюкозоэлектролитную смесь, курс 4—5 дней.
Больные были обследованы соответственно принятым стандартам [6]. Для оценки эффективности гепатотропной терапии определяли активность трансаминаз, содержание общего билирубина, щелочной фосфатазы. Показатели крови анализировали перед началом лечения, после каждого второго курса химиотерапии и через 1 мес после окончания лечения. Качество жизни изучали в группе больных, которым было выполнено оперативное лечение. При этом выделяли группы с органосохраняющими операциями и с экстирпацией кишки. Для оценки качества жизни использовали три основных типа опросников: общие, частные, специализированные. Наиболее распространенные из них предложены специальным отделом ВОЗ, который занимается проблемами качества жизни (WH0Q0L-100 (World Health Organization Quality of Life assessment), WHOQOL-BREF). Для оценки качества жизни применяли шкалу ECOG-WHO (Eastern Cooperative Oncology Group), опросники Medical Outcomes Study Short Form (SF-36), разработанной J. Ware и соавт. (Бримкулов Н.Н. и соавт., 1998; Ware J.E., 1993) [7, 8].
Для анализа и оценки полученных данных применяли стандартные методы описательной статистики (вычисление средних значений и их стандартных ошибок). Достоверность различий динамики показателей внутри групп определяли с помощью однофакторного дисперсионного анализа, парного и непарного критериев Стьюдента, критерия х2. Различия считали достоверными при р<0,05. Статистическую обработку результатов проводили с применением пакета программ Statistica 6.0 [9].
Результаты
Анализ динамики биохимических параметров в процессе лечения больных КРР был проведен в зависимости от схемы терапии (FOLFIRI или FOLFOX) и наличия метастазов. Выявлено, что увеличение показателей билирубина и трансаминаз у больных, получивших лечение по схеме FOLFIRI, изначально было более выражено в группе больных с метастазами в печени, максимальных значений показатель достигал на фоне 4—6-го курса терапии, но у больных, получивших ремаксол, изменения были менее значительными и улучшение показателей наступало быстрее. Вместе с тем динамика показателей щелочной фосфатазы имела одинаковую тенденцию у больных КРР с метастазами и без, но отличалась в зависимости от схемы терапии: при включении ремаксола исходно повышенные показатели нарастали и достигали максимальных значений к 4-му курсу ПХТ с последующим уменьшением ниже исходных параметров, в то время как в контрольной группе изначально более высокие показатели достигали максимальных значений на фоне 6-го курса ПХТ, и их снижение в дальнейшем были незначительны (рис. 1, 2).
Рис. 1. Динамика щелочной фосфатазы (ед/л) у больных колоректальным раком (схема FOLFIRI, 1-я группа без метастазов в печени).
Рис. 2. Динамика щелочной фосфатазы (ед/л) у больных колоректальным раком (схема FOLFIRI, 2-я группа с метастазами в печени).
Анализ данных печеночной активности у больных, получивших ПХТ по схеме FOLFOX, показал сходство по динамике показателей билирубина. В то же время, независимо от наличия или отсутствия метастатических процессов, выявлены изначально более высокие показатели трансаминаз, в отличие от данных больных, получивших лечение по схеме FOLFIRI: максимальные (в 2 раза выше нормы) значения АсАт и АлАт зарегистрированы на фоне 4-го курса ПХТ. Выявлено, что у больных с метастазами в печени уровень щелочной фосфатазы был выше, достигая максимальных значений на фоне 4-го курса ПХТ; у больных без метастазов — позднее, на фоне 6-го курса, и показывал более быструю и выраженную положительную динамику на фоне применения ремаксола (рис. 3, 4).
Рис. 3. Динамика щелочной фосфатазы (ед/л) у больных колоректальным раком (схема FOLFОХ, 1-я группа без метастазов в печени).
Рис. 4. Динамика щелочной фосфатазы (ед/л) у больных колоректальным раком (схема FOLFОХ, 2-я группа с метастазами в печени).
Анализ показателей качества жизни больных (по шкале ECOG-WHO) выявил более положительные результаты в 1-й группе, получивших ремаксол: 0—1 балл был зарегистрирован у 79,7%, в то время как во 2-й (контрольной) группе — у 65,1% больных (см. таблицу).
Показатели оценки качества жизни больных КРР (шкала ECOG—WHO) в зависимости от схемы терапии
При тестировании больных 1-ой группы было отмечено достоверное улучшение показателей физической активности: на +7 баллов после органосохраняющих операций (от 32,4±4,2 до 46,4±6,6, р=0,032) и на +4 балла после экстирпации прямой кишки (от 37,8±3,8 до 41,8±4,7, р=0,08). Выявлено увеличение показателя психического здоровья: на +4,75 балла у больных после органосохраняющих операций (от 43±5,88 до 47,75±6,1, р=0,08) и на +3 балла после экстирпации прямой кишки (от 36,3±1,2 до 39,3±1,9, р=0,06). Социальная активность больных увеличилась на +8 баллов у перенесших органосохраняющие операции (от 53,1±7,6 до 61,1±10,3, р=0,013) и на 4,5 балла после брюшно-промежностной экстирпации прямой кишки (от 43,1±7,8 до 47,6±8,6, р=0,024). При оценке своего психосоциального статуса после лечения 40 (48%) из 83 больных были удовлетворены, максимальное улучшение по шкале социальной активности отмечено у 71 (87,6%) больного.
Отмены ремаксола во время лечения не зафиксировано, препарат хорошо переносится больными при соблюдении рекомендаций по его введению.
Заключение
Эффективность терапии больных КРР Т4 с метастазами и без при включении в схему препарата ремаксол повышается за счет снижения гепатотоксичности проводимой полихимиотерапии, проявляющееся более быстрым и выраженным купированием показателей печеночной активности. Выявлено улучшения качества жизни больных за счет повышения показателей физической, психической и социальной активности в большей степени у перенесших органосохраняющие операции. Полученные результаты позволяют предложить включить ремаксол в качестве препарата сопроводительной терапии при проведении химиотерапевтического лечения у больных колоректальным раком.
Участие авторов:
Концепция и дизайн исследования: О.М., С.В
Сбор и обработка материала: О.М., С.В.
Статистическая обработка данных: О.М.
Написание текста: О.М.
Редактирование: О.М., С.В.
Конфликт интересов отсутствует.
Литература
1. Скрининг колоректального рака. Практическое руководство ВГО и Международного союза по профилактике рака пищеварительной системы. WGO; 2008.
2. Статистика злокачественных новообразований в России и странах СНГ в 2010 году. Под ред. Давыдова М.И., Аксель Е.М. М.: Издательская группа РОНЦ; 2012.
3. Сологуб Т.В., Горячева Л.Г., Суханов Д.С., Романцов М.Г., Антонова Т.В., Яковлев А.А., Радченко В.Г., Шульдяков А.А., Речник В.Н., Суздальцев А.А., Есауленко Е.В., Максимов С.Л., Баранова И.П. Гепатопротективная активность ремаксола при хронических поражениях печени. Клиническая медицина. 2010;1:62-66.
4. Безбородова О.А., Немцова Е.Р., Александрова Л.Н., Суханов Д.С., Коваленко А.Л., Якубовская Р.И. Оценка детоксицирующего действия препарата «Ремаксол» на экспериментальной модели токсикоза, индуцированного цисплатином. Экспериментальная и клиническая фармакология. 2011;3:26-31.
5. Коваленко А.Л., Петров А.Ю., Суханов Д.С., Саватеева Т.Н., Романцов М.Г. Ремаксол — препарат для восстановления системы антиоксидантной защиты при поражении печени циклофосфаном в эксперименте. Экспериментальная и клиническая фармакология. 2011;1:32-35.
6. Минимальные клинические рекомендации Европейского Общества Медицинской Онкологии (ESMO). Под ред. Тюляндина С.А., Носова Д.А. М.: Издательская группа РОНЦ им. Н.Н. Блохина РАМН; 2010.
7. Ware JE. Measuring patients’views: the optimum outcome measure. Br Med J. 1993;306:1429-1430.
8. Бримкулов Н.Н., Сенкевич Н.Ю., Калиева А.Д. Применение опросника SF-36 для оценки качества жизни. Центрально-азиатский медицинский журнал. 1998;4-5:236-241.
9. Халафян А.А. STATISTICA 6.0. Статистический анализ данных. Учебник. 3-е изд. М.: БИНОМ-Пресс; 2008.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- Доставка и оплата
- Акции и скидки
- Букинист
- Наши магазины
- Организациям
- Лекторий
Вход / Регистрация
Гипермаркет для медиков

Время работы (по Москве)
пн • вт • ср • чт • пт • сб • вс
9-20
Звонок по России бесплатный
8-800-555-999-2
Товаров на
0 руб.

Сопроводительная терапия в онкологии. Практическое руководство
| Артикул | NF0000858-P |
|---|
| Издательство |
ГЭОТАР-Медиа |
|---|
от 280 руб.
| Размер | |
Количество Сопроводительная терапия в онкологии. Практическое руководство
-
Комментарии
Отзывов пока нет.
Помогите коллегам в поисках полезной информации! Оцените книгу, пожалуйста!
Для публикации отзыва войдите на сайт, используя E-mail или социальные сети.
Войти с помощью:
© ООО «Издательство «Литтерра»
- Доставка/Оплата
- Скидки и акции
- Написать нам
- Наши магазины
- Организациям
В статье представлены результаты исследования, посвященные вопросам сопроводительной нутриционно-метаболической терапии больных колоректальным раком
Введение
При опухолях пищеварительного тракта проводят сопроводительную нутриционную поддержку (НП) с целью профилактики метаболических осложнений. Существуют 3 направления сопроводительной нутриционной коррекции: 1) базовая сопроводительная нутритивная коррекция пациентов с онкопатологией в целом; 2) нутриционная реабилитация пациентов с онкопатологией и сопутствующими заболеваниями; 3) нутриционная помощь паллиативным пациентам. В каждом из направлений учитываются известные к настоящему времени основные метаболические синдромы, характерные для онкопациентов. Говоря об особенностях метаболического ответа при раке, следует отметить, что фаза ebb может не иметь очерченной клинической картины и при выраженном окислительном стрессе и угнетении CARS быстро перейти в фазу flow. Присутствие синдрома анорексии-кахексии (САСS) со снижением аппетита, массы тела (более чем на 5% за 6 мес.), индекса мышечной массы приводит к прекахексии, кахексии вплоть до рефрактерной кахексии (от 0 до 100 баллов). Синдром гиперметаболизма-гиперкатаболизма, выражающийся в реакции мышечного протеолиза, саркопении, повышенном уровне цитокинов, росте энергетических и пластических потребностей, высокой скорости окисления липидов, толерантности организма к пищевым веществам при сниженной скорости окисления глюкозы и росте белковых потерь (потери Pt<6 г/сут соответствуют I степени, 12 г/сут — II степени и >12 г/сут — тяжелой степени), ведет к росту индекса нутриционного риска [1]. Благодаря работам Ю.М. Гальперина, А.М. Уголева и их соратников (Л.Н. Костюченко, Т.З. Иванова, М.В. Руденская, М.Я. Симонов и др.) выделен также синдром кишечной недостаточности и определены фундаментальные основы энтеральной зондовой алиментации (принцип химусоподобия как критерий наибольшей усвояемости рационов, учет процессов гетерофазного полостного пищеварения на флоккулах, необходимость коррекции микробиоты кишечника и др.). В целом процессы мышечного катаболизма и механизмы протеолиза описаны во многих исследованиях [2, 3], выявивших пути деградации белка, мышечного истощения за счет убиквитин-протеасомной системы [4], белка дистрофина, ферроптоза, цитоплазматической гипоксии и др. В выборе составов для нутриционного сопровождения существенную роль играют и сведения о метаболизме самой опухолевой клетки. Например, нормальная клетка может усваивать гликоген, а раковая — глюкозу; нормальные клетки мало поглощают фолат, а раковые клетки, имея рецепторы для захвата этого витамина, жадно его поглощают; раковые клетки поглощают бор в 3–4 раза больше, чем здоровые, и т. д.
Принципы подбора программ нутриционной поддержки онкопациентов
Важную роль для прогноза и выбора схем нутриционной коррекции играет содержание общей и внеклеточной воды организма (рост этих параметров свидетельствует о рефрактерности усвоения нутриентов). Важными для расчета НП особенностями онкопроцесса (особенно в условиях паллиатива) оказались также стадия опухолевого процесса [5], тип (объем) выполненной операции [6], исходный нутриционный статус, фаза канцерогенеза (инициация, промоция, прогрессия) [5], режим проводимой химиотерапии [7, 8]. Если эти факторы не учитываются, то могут возникнуть метаболические токсические осложнения. Все это способствовало возникновению нового подхода к нутриционной сопроводительной терапии в комплексном лечении опухолей, учитывающего возможности детоксикационной алиментации.
Одно из значимых направлений современного нутриционного сопровождения в онкологии — иммунонутрициология [9–12], диктующая необходимость включать в структуру сопроводительной нутритивной коррекции нутриенты, влияющие на клеточный и гуморальный иммунитет (рис. 1).
![Рис. 1. Различные нутриенты, влияющие на клеточный и гуморальный иммунитет [13] Рис. 1. Различные нутриенты, влияющие на клеточный и гуморальный иммунитет [13]](https://www.rmj.ru/upload/medialibrary/057/37-1.png)
Особое внимание необходимо уделять функциональному резерву органов, лимитирующих усвоение. В частности, в ранее выполненных работах нами показано, что при угнетении функций кишечника следует выбирать тактику постепенного нагнетания пищевой нагрузки (вначале применять солевые энтеральные растворы, затем частично гидролизованные составы и лишь потом постепенно переходить к сбалансированным смесям и высокобелковым высокоэнергетическим рационам [14], что позволяет избежать метаболических осложнений и нежелательных дополнительных токсических эффектов. При выборе программ сопроводительной НП также необходимо обращать внимание на характер и объем оперативного вмешательства [6], учитывать влияние на нутритивный статус сопутствующих заболеваний и применяемых для их лечения препаратов. Например, при введении нутритивных смесей в сочетании с анальгетиками опиоидного действия нужно учитывать тормозное действие последних на перистальтику и, как следствие, на процессы всасывания. При таких условиях в состав нутриционных программ вводят смеси с пищевыми волокнами (лактулозой и др.). При подборе схем сопроводительной НП оценивают и микробиом кишечника. Нам удалось выделить 3 типа его изменений, в зависимости от которых программа НП дополнялась соответствующими фармсредствами. При угнетении активности микробиоты мы вводили в программу препарат оболочек семян подорожника овального или метабиотик, при демпингоподобном синдроме — корректоры двигательной активности, при синдроме избыточного бактериального роста — нифуроксазид или его аналоги.
Как известно, в основе модуляции детоксикационного ответа лежат следующие основные механизмы: 1) монооксигеназная система печени; 2) специфическая и неспецифическая иммунная система; 3) выделительная система почек, кишечника, легких. Поэтому для детоксикационной алиментации в схемы сопроводительной НП рекомендуется вводить корректоры микробиоты (бифидобактерии
бифидум), противовоспалительные препараты (препараты омега-3 жирных кислот (ЖК)), иммунокорректоры (азоксимера бромид по 6–12 мг 1 р./сут через день в течение 5 дней), нутриенты-детоксиканты (смеси для лечебного питания и иммунопитания до 500 ккал/сут, гепатопротекторы или фосфолипиды в стандартной дозе в течение недели). Остальной необходимый рассчитанный калораж нужно восполнять специализированными сипинговыми смесями для онкопациентов с добавлением диетического рациона. Исходя из перечисленных позиций определяется объем НП и формируются нутриционные программы для онкологических пациентов. В соответствии с обозначенными критериями пациентов подразделяют на группы, каждой из которой соответствуют определенные параметры нутриционного статуса (табл. 1).
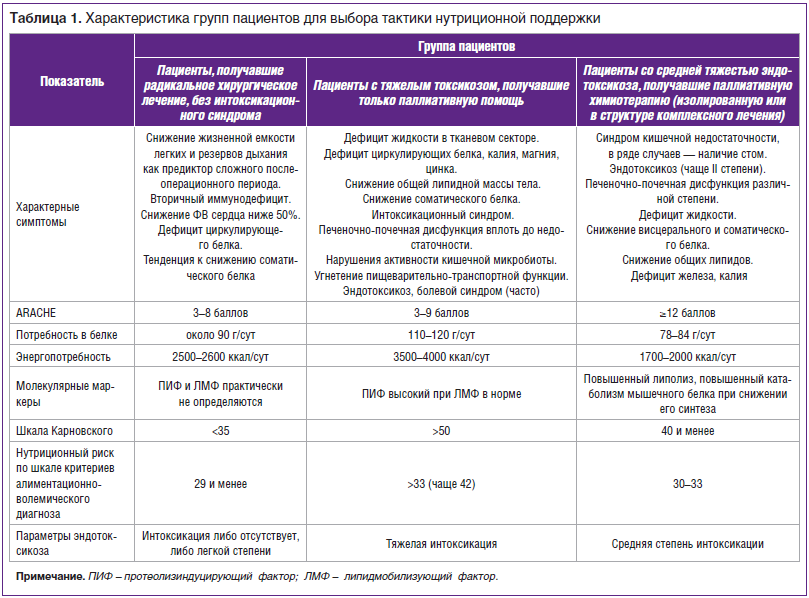
Для диагностики и динамического наблюдения за детоксикационной НП следует использовать алиментационно-волемический диагноз. Он включает полное исследование нутриционных параметров и позволяет оценить функциональный резерв органов, лимитирующий усвоение нутриентов, обеспечивающих метаболическую безопасность и предотвращающих развитие интоксикации. По выраженности интоксикацию подразделяют на: 1) легкой степени, которая хорошо поддается терапии; 2) средней степени тяжести с длительным воздействием на системы и органы, с развитием осложнений; 3) тяжелой степени — опасную форму, при которой поражаются все органы и системы, а интенсивный распад опухоли приводит к гибели больного.
Проводя профилактику метаболических осложнений, необходимо учитывать наличие дефицита неэтерифицированных ЖК (НЭЖК), необходимых для синтеза фосфолипидов и построения клеточных структур, в т. ч. митохондрий. Дефицит НЭЖК встречается, по данным литературы, в 30–32% случаев НП и развивается уже через 2–3 дня неправильного парентерального питания без использования липидов (1–2% от калорической потребности надо обеспечивать этими веществами) [15]. В то же время нужно помнить об угрозе синдрома жировой перегрузки (метаболической патологии с развитием гиперлипидемии, лихорадки, гепато- и спленомегалии, анемии, лейкопении, тромбоцитопении, нарушения коагуляции, гемолиза и ретикулоцитоза, отклонения функциональных печеночных тестов). При назначении жировых эмульсий без учета противопоказаний к их назначению (билирубин более 90, липоидный нефроз, гипогликемия, декомпенсированный сахарный диабет и др.) развиваются ятрогенные триглицеридемии. Возможно развитие наведенной азотемии и гипераминоацидемии, когда показаны среды направленного действия (содержащие L-орнитин, L-аспартат).
Исследование эффективности введения сбалансированного инфузионного раствора в схему детоксикационной нутритивной поддержки
Материал и методы
В проспективное слепое исследование включены 57 пациентов с метастазами колоректального рака (КРР) в печень, подвергнутых хирургическому или комбинированному лечению. Все наблюдавшиеся пациенты были сопоставимы по полу и возрасту. В программах нутриционной детоксикации использовали высокобелковые питательные смеси, содержащие омега-3 ЖК, гепатопротектор, аминокислотный состав направленного действия, пробиотики и фосфолипиды. В основной группе (30 пациентов) в программу детоксикационной НП добавляли Ремаксол® из расчета 400 мл со скоростью 40 капель в минуту в течение 10 дней. В контрольной группе (27 пациентов) инфузии Ремаксола не назначались. При этом нутриционную недостаточность оценивали по критериям алиментационно-волемического диагноза, нутриционному риску по NRI. Саркопению оценивали с помощью биоимпедансометрии. Гематологические индексы интоксикации (индексы Кребса, Гаркави, индекс соотношения лейкоцитов и СОЭ — ИЛСОЭ) рассчитывали по рекомендуемым формулам [16–18]. Гепатологические параметры (общий белок, альбумин, билирубин, АЛТ, ЛДГ) определяли по общепринятым методикам. Возможности кишечника в плане детоксикации отслеживали по уровням цитруллина плазмы и активности кишечной микробиоты (по результатам изучения летучих ЖК копрофильтрата). Кроме того, исследовали содержание мочевины и креатинина крови, ее электролитный состав. Тяжесть состояния оценивали по APACHE II, качество жизни — по ECOG. Для объективизации полученных результатов использовали математические методы — факториальный анализ и метод вариационной статистики с применением критерия Стьюдента.
Сопроводительную НП в каждом случае подбирали индивидуально. Описанный нами ранее рост объема внеклеточной и общей жидкости в организме расценивали как прогностически неблагоприятный и также учитывали при инфузионно-нутритивной коррекции, этот фактор влиял на выбор программы именно детоксицирующей алиментации. При этом ятрогенные дисгликемии встречались реже, т. к. инсулинорезистентность даже при хирургическом диабете предусматривала обязательную консультацию пациента эндокринологом [19–20]. В отдельных случаях возникали дизэлектролитемии (дефицит или перегрузка железом, дисбаланс кальция, магния, селена, цинка). В наших наблюдениях у пациентов с КРР чаще встречались корригируемые железодефицитные состояния, тактика при которых нами описана в ряде работ [6]. При выборе сопроводительной НП учитывали также, что в средах парентерального питания нет микро- и макроэлементов. Оценивали выраженность интоксикационного синдрома, который определяет тяжесть состояния, качество жизни и другие функции организма и потребности в нутриентах.
Результаты исследования
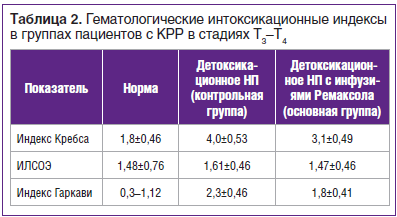
Выявлена связь между нарушениями гомеостаза и развитием эндотоксикоза у пациентов с КРР в стадиях Т3–Т4. Кроме того, определена выраженность гематологических параметров эндотоксикоза при применении традиционной детоксикационной НП и схемы детоксикационной НП с добавлением Ремаксола. Отмечена более выраженная эффективность программы нутриционной детоксикации с применением Ремаксола (табл. 2).
Для большей объективизации течения эндотоксикоза на данном этапе работы мы попытались дать сравнительную количественную оценку его выраженности с привлечением математического аппарата (табл. 3). Для количественной характеристики признаков использовали показатель, отражающий процентное отклонение от нормы исследуемого параметра:
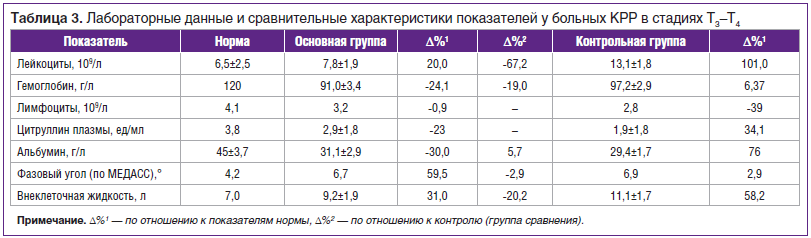
⎛В-А⎞
∆% = ——— 100%,
⎝ А ⎠
где А — начальное, В — измененное значение оцениваемого параметра.
Таким образом, детоксикационная НП с Ремаксолом у оперированных пациентов с КРР, получавших химиотерапию, позволяла более эффективно снижать нарастание нарушений в системе гомеостаза, а частота гепатотоксических осложнений химиотерапии, как и в литературных данных [12], варьировала от 14,3 до 100%. При этом, как видно из факториального анализа, для дальнейшего совершенствования детоксикационных мероприятий может быть использована не только гепатопротекторная коррекция, но и нутритивная, направленная на механизмы кишечной детоксикации, что, как известно, связано с циклом превращений орнитина-цитруллина в безопасную мочевину.
Обсуждение результатов
Следует отметить, что интоксикация, развивающаяся при онкологии, наступает практически у каждого больного. Связано это с тем, что при злокачественных новообразованиях нарушаются процессы нормального метаболизма, и в тканях, и в биологических жидкостях организма накапливаются токсические эндогенные элементы. Эндогенное отравление при онкологии обусловливают одновременно сразу нескольких провоцирующих факторов: а) нарушение процессов метаболизма; б) распад злокачественной опухоли; в) накопление применяемых во время лечения лекарственных препаратов; г) выделение опухолями специфических веществ (PIF и др.), иммуносупрессантов; д) осложнения химио- или лучевой терапии; е) метаболические осложнения нутритивной коррекции. Понятно, что причиной интоксикации организма при онкологии на ранних стадиях является циркуляция продуктов метаболизма клеток новообразования в крови, на поздних стадиях — распад опухоли. При распаде опухоли в крови происходят значимые электролитные и обменные нарушения (табл. 4).
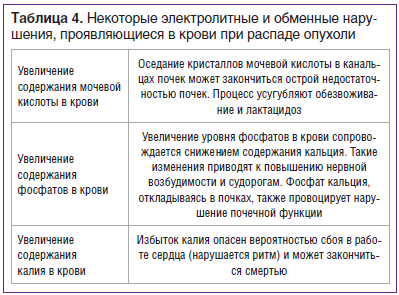
Продукты метаболизма распадающейся опухоли повреждают мембранные структуры нормальных клеток различных органов, инициируют перекисное окисление жиров, образуют опасные частицы — свободные радикалы, в результате повреждающего действия которых у больных, страдающих раком, отмечается склонность к гемолизу эритроцитов, снижается уровень гемоглобина. При интоксикации организма у онкологических больных наблюдаются общие симптомы: головная боль, повышение температуры, тошнота, рвота, неустойчивый стул, пониженный аппетит, слабость, утомляемость, сонливость, ощущение перебоев в сердце, тахикардия, перепады артериального давления, снижение массы тела, бледность, акроцианоз, синюшность губ, одышка, признаки почечной и печеночной недостаточности, лейкоцитоз, повышение СОЭ, снижение уровня белка, эритроцитов и пр.
Профилактика и лечение раковой интоксикации довольно сложны. Необходимо регулярно следить за содержанием электролитов, функцией печени и почек, контролировать уровень гемоглобина и свертывающую способность крови. Необходимо учитывать и дополнительные патогенетические механизмы, участвующие в развитии интоксикации: 1) изменения в гепатоэнтеральной циркуляции;
2) изменения в традиционных детоксикационных системах; 3) сдвиги в спектре микробиоты кишечника. Помимо употребления жидкости в достаточном объеме, своевременного опорожнения кишечника, контроля состояния сердечной деятельности показано детоксикационное питание — еще одно новое направление онконутрициологии.
Для оценки тяжести раковой интоксикации применяют, как правило, стандартные показатели, используя при этом различные шкалы. Оцениваются также степень тяжести гепатотоксичности и частота гепатотоксических реакций при применении различных противоопухолевых препаратов [7]. Традиционно лечение раковой интоксикации симптоматическое, включает, как правило, противорвотные препараты, слабительные средства, клизмы (при неэффективности слабительных препаратов), сорбенты, препараты железа при анемии, нестероидные противовоспалительные, антиаритмические, седативные препараты, энтеросорбцию, при наличии тяжелых электролитных нарушений — гемодиализ или плазмаферез.
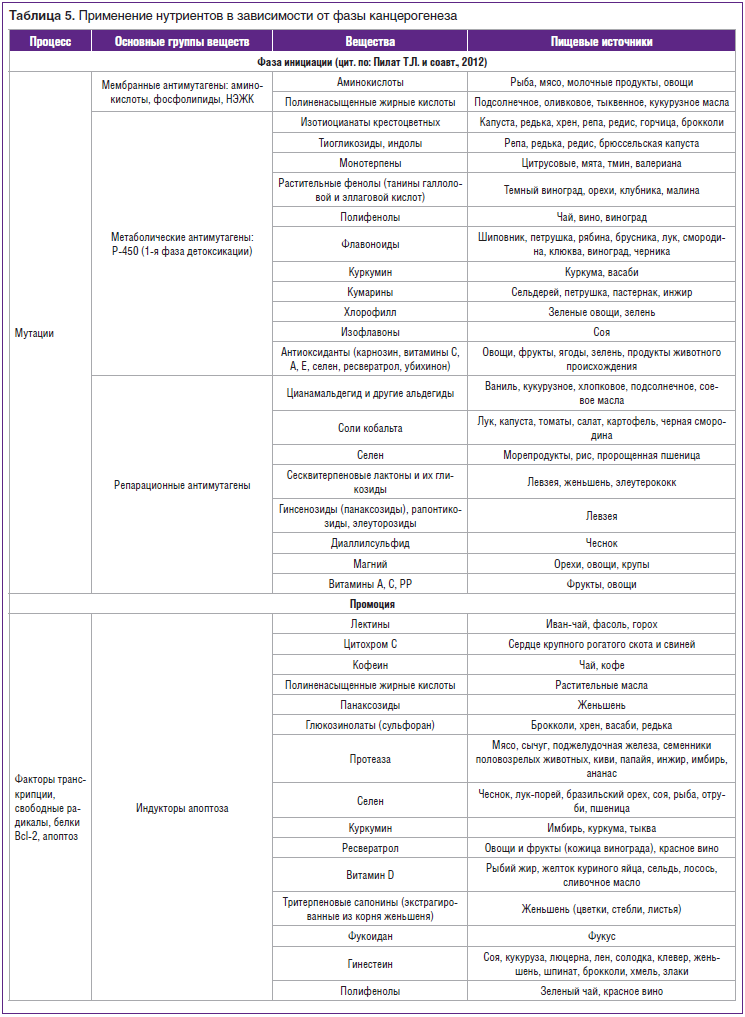
Однако к настоящему времени исследованы и некоторые факторы диеты, влияющие на эндогенную продукцию N-нитрозокомпонентов, многие из которых обладают выраженной канцерогенной и мутагенной активностью. Так, показано, что добавление в пищу бифидогенных факторов — олигосахаридов сои — приводит к значительному снижению содержания общих N-нитрозокомпонентов в фекалиях крыс [21, 22]. Выявлена и детоксикационная роль белков натуральных продуктов за счет специфической системы биоадсорбции для глутатиона [23], липидов омега-3 [24], углеводов через образование глюкуроновой кислоты и НАДФ-Н [25]. Имеется ряд рекомендаций по использованию натуральных нутриентов в зависимости от фазы канцерогенеза (табл. 5).
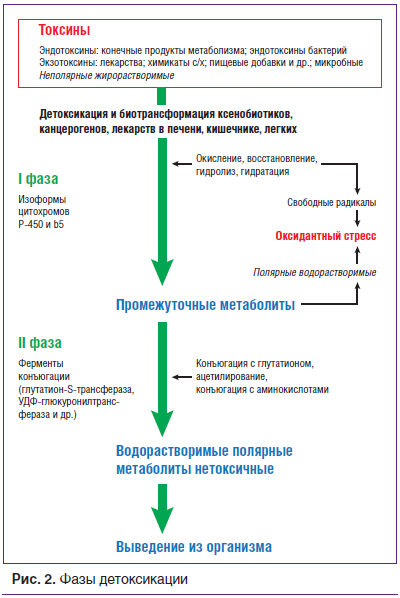
В целом препаратов и нутриентов-детоксикантов гепатопротекторного действия достаточно много, механизм действия их весьма разнообразен. До настоящего времени не сложилась их единая классификация, видимо, из-за того, что их строение и место приложения действия довольно сильно различаются. К гепатопротекторным средствам относят витамины группы В, витамин Е, аминокислоты (особенно карнитин, орнитин, метионин), бетаин, желчегонные препараты, углеводы, флавоноиды, органические кислоты, метилурацил. Эти препараты можно разделить на группы: растительные препараты; препараты животного происхождения; минеральные препараты; синтетические препараты. Разделяют и фармаконутриенты, влияющие на определенную фазу детоксикации. Например, глутамил-цистеинил-глицин динатрия стимулирует ферменты 2-й фазы детоксикации (рис. 2) в клетках печени (гемооксигеназа-1, Г6ФД, глутатионредуктаза) и, как следствие, способствует нейтрализации токсических продуктов, в т. ч. образующихся при гибели раковых клеток. Этот препарат восстанавливает утраченную при химиотерапии и раковой интоксикации чувствительность рецепторов к циркулирующим в крови цитокинам (фактор некроза опухоли, интерлейкин 1 и др.).
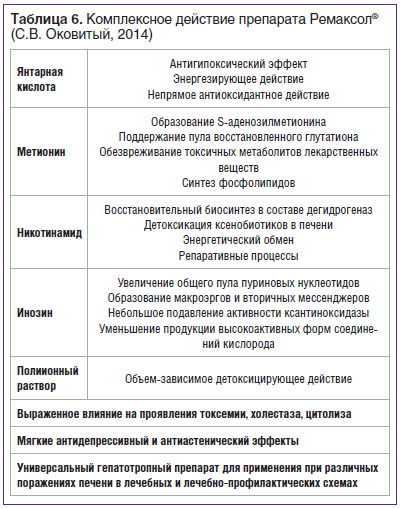
Использованный нами в структуре программы нутриционной детоксикации Ремаксол® обладает одновременно целым рядом эффектов. В состав Ремаксола входят действующие вещества: янтарная кислота (5,28 г), метионин (0,75 г), инозин (2,0 г), никотинамид (0,25 г); N-метилглюкамин (8,725 г) в качестве трансмембранного переносчика, а также вспомогательные вещества: натрия хлорид 6,0 г, калия хлорид 0,3 г, магния хлорид 0,12 г, натрия гидроксид 1,788 г, вода для инъекций до 1 л.
Благодаря такому комплексу удачно подобранных компонентов (табл. 6) Ремаксол®, как показало исследование, успешно включается, помимо корректоров микробиоты, противовоспалительных нутриентов, иммунокорректоров, в протоколы алиментационной детоксикации, что позволяет предотвратить метаболические осложнения при проведении базового лечения КРР.
В последние годы появилась метаболическая эррология — наука о метаболических осложнениях (в т. ч. ятрогенных), к которым можно отнести, как указывалось выше, синдром жировой перегрузки, дефицит НЭЖК [11], наведенную азотемию, гипераминоацидемию, дисгидрии, ятрогенные дисгликемии [19, 20], тяжелую, резистентную к коррекции белково-энергетическую недостаточность [21, 26], дизэлектролитемии (в т. ч. весьма опасный дефицит циркулирующего калия, натрия, магния и др., железодефицит или гемосидероз, дефициты других электролитов и микроэлементов и т. д.). В результате таких осложнений возникают различные дефицитные состояния и интоксикационные синдромы. Их контролю служит одно из направлений метаболической эррологии, объединяющее детоксикационное питание, детоксикационную нутриционную коррекцию, особенно необходимую для пациентов с онкологическими заболеваниями пищеварительного аппарата.
Выводы
Сопроводительная НП — одно из перспективных направлений персонализированного лечения, в частности при опухолях пищеварительного тракта (КРР).
Детоксикационная НП при КРР способствует существенному очищению организма от токсикантов.
Для выведения токсикантов целесообразно дополнять стандартные методики детоксикации составами нутриционного действия для сипинга с детоксицирующими составляющими и гепатопротекторным действием.
Перспективным представляется исследование расширения возможностей детоксикационной НП в структуре терапии сопровождения.



