Диагностика и лечение гемофилии
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Наследственный дефицит фактора IX (D67), Наследственный дефицит фактора VIII (D66)
Разделы медицины:
Гематология, Гематология детская
Общая информация
Краткое описание
НАЦИОНАЛЬНОЕ ГЕМАТОЛОГИЧЕСКОЕ ОБЩЕСТВО
Рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018)
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ по ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ГЕМОФИЛИИ
Введение
Гемофилия — наследственное заболевание свертывающей системы крови, возникающее в результате дефицита фактора свертывания крови VIII (FVIII) — гемофилия А, или фактора свертывания крови IX (FIX) — гемофилия B.
Гемофилия передается по X-сцепленному рецессивному пути наследования. Примерно у 70% больных имеется положительный семейный анамнез по заболеванию. Причиной гемофилии являются мутации гена, кодирующего FVIII (Xq28), или гена, кодирующего FIX (Xq27). В 30-35% случаев возможны спорадические мутации без наличия семейного анамнеза заболевания.
Распространенность гемофилии по населению в целом оценивается как 1:10 000. Гемофилия A (ГA) встречается чаще, чем гемофилия B (ГB) и составляет 80—85% общего числа случаев. Подавляющее большинство больных гемофилией— мужчины. Известны единичные случаи гемофилии у женщин при наследовании гена одновременно от отца (больного гемофилией) и от матери (носителя гена), либо у женщины с мутацией гена на одной хромосоме, когда ген на другой хромосоме неактивен (болезнь Шерешевского-Тернера и др.). У некоторых женщин, являющихся носительницами мутаций генов FVIII или FIX, также могут наблюдаться клинические проявления гемофилии [1].
Кодирование по МКБ-10: D66.0 – Наследственный дефицит фактора VIII и D67.0 — Наследственный дефицит фактора IХ.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация
Классификация гемофилии по степени тяжести основана на определении активности FVIII и FIX (табл.1).
Таблица 1. Классификация гемофилии по степени тяжести
Около 60-70% всех диагностированных случаев гемофилии составляют тяжелые формы заболевания, для которых характерны спонтанные геморрагические эпизоды (преимущественно гемартрозы и гематомы мягких тканей различных локализаций). Степень тяжести нарушений свертывания крови и клинических проявлений при гемофилии зависит, как правило, от уровня активности фактора в крови, однако в клинической практике не всегда существует прямая корреляция между лабораторным и клиническим фенотипами заболевания [2, 3].
Клиническая картина
Cимптомы, течение
Клинические признаки
Основное проявление гемофилии – кровотечения и кровоизлияния, возникающие спонтанно или вследствие травмы (табл.2). ГА и ГВ имеют схожую клиническую картину [2].
Таблица 2. Клинические проявления гемофилии
Для тяжелой формы гемофилии характерно появление геморрагического синдрома на первом году жизни с начала активного периода у ребенка (гематомы мягких тканей, посттравматические кровотечения из слизистых, гемартрозы). Поражаются в основном крупные суставы: коленные, голеностопные, локтевые и тазобедренные.
Гемофилия средней тяжести имеет сходные проявления. Первые признаки, как правило, развиваются после года. У пациентов с активностью факторов более 2% реже возникают кровоизлияния в суставы, забрюшинные гематомы, гематурии. Наиболее типичны посттравматические гематомы и длительные кровотечения, особенно при травмах слизистых оболочек.
Легкая гемофилия может никак не проявляться на протяжении всей жизни. Геморрагический синдром обычно возникает вследствие значительных травм или при хирургическом лечении. Поражение опорно-двигательного аппарата встречается чрезвычайно редко [3-4].
Диагностика
Диагностика
Диагностика гемофилии начинается с выявления наличия геморрагического синдрома в анамнезе у пациента и членов семьи.
При сборе анамнеза заболевания и семейного анамнеза пациента рекомендуется выяснять наличие проявлений геморрагического синдрома: жалоб на легко появляющиеся экхимозы и гематомы в раннем детстве; возникновение спонтанных кровотечений (особенно в суставы, мышцы и мягкие ткани); длительных кровотечений после травм или хирургического вмешательства [3].
Данные семейного анамнеза примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по материнской линии (у мужчин, реже у женщин). Данные персонального анамнеза могут содержать информацию о геморрагических проявлениях у пациента. При сборе анамнеза заболевания необходимо обращать внимание на наличие геморрагических проявлений в неонатальном периоде в виде кефалогематом, внутричерепных кровоизлияний, кровоточивости и длительном заживлении пупочной ранки; у грудных детей – экхимозов, не связанных со значимой травмой, гематом мягких тканей после незначительных ушибов или спонтанных. У некоторых детей кровотечения могут отсутствовать на первом году жизни до тех пор, пока ребенок не начнет ходить [2]. Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и (или) множественные гематомы, системность геморрагических проявлений (проявления различной локализации), «спонтанные геморрагические проявления». При легкой форме гемофилии кровотечения могут отсутствовать до первой травмы или хирургического вмешательства. Сбор жалоб и анамнеза позволит определить объем обследования пациента.
При проведении физикального осмотра рекомендуется обращать внимание на наличие кожного геморрагического синдрома различной выраженности в виде множественных экхимозов и гематом, возможных при тяжѐлой и среднетяжелой форме гемофилии [4]. Высоковероятно выявление признаков поражения суставов в виде деформации, отека и локального повышения температуры кожи (острый гемартроз) и/или признаков нарушения подвижности, объема движений суставов, гипотрофии мышц конечности на стороне поражѐнного сустава, нарушение походки (деформирующая артропатия).
Лабораторная диагностика
Рекомендуется проведение поэтапного лабораторного коагулологического исследования с целью верификации диагноза и исключения приобретенных дефицитов FVIII/FIX, а также исключения дефицита других факторов свертывания крови [1, 5, 6].
В качестве первого этапа рекомендуется проводить коагулологический скрининг, в ходе которого определяется следующее:
- активированное частичное тромбопластиновое время (АЧТВ);
- протромбиновое время (ПВ);
- тромбиновое время (ТВ);
- концентрацию фибриногена (по Клауссу);
- время кровотечения стандартизованным методом (например, по Айви, или с помощью анализаторов функции тромбоцитов PFA-100 и PFA-200);
- подсчет количества тромбоцитов по Фонио.
Для гемофилии характерно увеличение АЧТВ, удлинение времени свертывания крови при сохранении других показателей в пределах нормальных значений. Необходимо иметь ввиду, что при проведении скрининга у пациентов с легкой формой гемофилии возможны нормальные значения АЧТВ.
Второй этап диагностики рекомендуется выполнять при выявлении изолированного удлинения АЧТВ, либо при отсутствии изменений в ходе скрининга у пациентов с клиническими признаками легкой формы гемофилии [6]. На данном этапе определяют активность факторов плазменного гемостаза — FVIII, FIX, фактора фон Виллебранда (vWF), факторов свертывания крови XI и XII.
При выявленном снижении активности FVIII или FIX третьим этапом диагностики рекомендуется выполнять определение специфического ингибитора к сниженному фактору. При снижении активности нескольких факторов свѐртывания крови и/или удлинении фосфолипид-зависимых тестов (АЧТВ с чувствительными реактивами) проводится определение неспецифического ингибитора (волчаночного антикоагулянта).
Для исключения приобретенных дефицитов FVIII, FIX рекомендуется молекулярно-генетическая диагностика нарушений FVIII, FIX [7].
У части больных могут проводиться интегральные тесты оценки гемостаза: исследование свойств сгустка крови (тромбодинамика), тромбоэластография, тест генерации тромбина. Проведение интегральных тестов целесообразно, если нет возможности провести полноценную трехэтапную коагулологическую оценку, а также в некоторых случаях для контроля за проводимой терапией.
Критерии диагноза гемофилии (при наличии геморрагического синдрома в анамнезе больного или семейном анамнезе) [3, 6, 7]:
- отсутствие приобретенных коагулопатий;
- снижение активности FVIII/FIX ниже 50%;
- наличие мутаций генов FVIII или FIX.
Диагноз устанавливается при наличии как минимум двух из трех критериев.
Инструментальная диагностика позволяется визуализировать кровотечения/кровоизлияния различных локализаций, а также выявить осложнения, развившиеся вследствие геморрагических проявлений. По показаниям проводятся следующие обследования:
эзофагогастродуоденоскопия;
- ультразвуковое исследование сустава;
- ультразвуковое исследование органов брюшной полости;
- ультразвуковое исследование мочевыводящих путей;
- ультразвуковое исследование забрюшинного пространства;
- магнитно-резонансная томография сустава, мягких тканей;
- магнитно-резонансная томография головного мозга;
- рентгенография сустава;
- компьютерная томография органов грудной клетки;
- компьютерная томография головного мозга.
Для подтверждения наличия геморрагических проявлений (или их последствий) также рекомендуется проведение консультации специалистов. По показаниям возможны консультации [8]:
- травматолога-ортопеда
- хирурга
- уролога
- невролога
- оториноларинголога
- стоматолога
Лечение
Лечение
Основным принципом лечения гемофилии является специфическая заместительная терапия концентратами факторов свертывания.
Необходимо использовать очищенные, вирусинактивированные препараты, изготовленные из донорской плазмы человека (концентрат FVIII, концентрат FIX, концентрат FVIII + фактор фон Виллебранда, антиингибиторный коагулянтный комплекс [АИКК]) или рекомбинантные концентраты факторов свертывания (Октоког альфа, Мороктоког альфа, Нонаког альфа, Эптаког альфа (активированный), Симоктоког альфа, Туроктоког альфа). В настоящее время нет оснований для предпочтения друг другу плазматических (содержащих или не содержащих фактор фон Виллебранда) или рекомбинантных факторов свертывания. Поскольку частая смена торговых наименований препаратов FVIII и FIX может привести к повышению риска появления ингибитора, желательно создать условия для длительного (на протяжении многих лет) применения пациентом одного типа препаратов по МНН.
Рекомендуется отдавать предпочтение тому препарату, который при равной эффективности лучше всего переносится пациентом, имеет лучшие фармакокинетические индивидуальные показатели и наиболее удобен в использовании, исходя из конкретных условий [4, 7, 9]. Смена МНН у конкретного пациента при отсутствии зарегистрированных нежелательных явлений на введение используемого препарата и удовлетворительном клиническом ответе на терапию возможна после 100 экспозиционных дней введения концентратов факторов свертывания крови.
Концентраты факторов свертывания крови вводятся внутривенно. Чаще всего используется болюсная инфузия со скоростью, рекомендованной производителем. В редких случаях возможно применение непрерывной инфузии при наличии подобного опыта у лечащего врача. Современная терапия гемофилии базируется на принципе «домашнего лечения». Обязательными условиями для проведения «домашнего лечения» являются: наличие у пациента гемостатических препаратов (препарат находится там же, где пациент), решение о применении гемостатического препарата принимает пациент или его родственники в соответствии с рекомендациями гематолога, пациент и/или его родственники обучены правилам хранения и использования препаратов.
Использование неочищенных препаратов – компонентов крови (свежезамороженной плазмы или криопреципитата) – рекомендовано только в исключительных случаях и не должно являться постоянной практикой.
Существует два вида специфической терапии – лечение по факту возникновения кровотечений (по требованию) и профилактическая терапия [4].
Лечение кровотечений (по требованию)
В случае развития кровотечения/кровоизлияния проводится гемостатическая терапия концентратами факторов свертывания крови с расчетом доз препаратов и продолжительности лечения в зависимости от целевого значения активности дефицитного фактора и вида кровотечения (табл. 3).
Во всех случаях рекомендовано сразу использовать достаточную дозу и соблюдать кратность введения препарата [6]. Использование низкой дозы и несоблюдение режима введения снижают эффективность терапию, ведут к ухудшению состояния больного и увеличению расхода препарата. Слишком высокая доза может привести к развитию тромбозов и неоправданно повышает расход препарата.
Имеющиеся индивидуальные колебания фармакокинетических параметров у каждого пациента требуют персонифицированной оценки фармакокинетической кривой по показаниям. В случае если у пациента такой анализ проведен, расчет дозы и кратности введения должен проводиться специалистом с учетом имеющихся данных.
При отсутствии данных об индивидуальных особенностях фармакокинетики возможно использование усредненных значений: период полувыведения FVIII составляет около 8—12 часов, период полувыведения FIX — около 24 часов.
При введении в дозе 1 МЕ/кг активность FVIII повышается в среднем на 2% (у пациентов старше года) (восстановление активности FVIII — тест восстановления = 2), FIX — в среднем на 1% (тест восстановления = 1).
Таблица 3. Рекомендуемые уровни фактора и продолжительность терапии при различных видах кровотечений
У детей первого года жизни степень повышения активности FVIII может быть меньше — 1%.
Расчет дозы концентрата FVIII у пациентов старше 1 года проводится следующим образом: доза (МЕ) = масса тела (кг) х (требуемая активность – базальная активность) х 0,5.
Расчет дозы концентрата FVIII у детей первого года жизни проводится следующим образом: доза (МЕ) = масса тела (кг) х (требуемая активность – базальная активность).
Расчет дозы концентрата FIX проводится следующим образом: доза (МЕ) = масса тела (кг) х (требуемая активность – базальная активность).
Для экстренного контроля эффективности терапии допустимо использование теста АЧТВ или тромбоэластографии (необходимо получить нормальные или субнормальные значения), однако данные этих тестов не позволяют дифференцировать значения активности выше 40—50%.
Учитывая вариабельность фармакокинетических показателей у каждого конкретного пациента заместительная терапия требует клинического и, при необходимости, лабораторного контроля. Клинический контроль должен проводиться гематологом при обращении пациента, родителями и самим пациентом постоянно. В основе клинического контроля лежит оценка динамики геморрагических проявлений и ее сопоставление с проводимой заместительной терапией. Лабораторный контроль включает определение активности дефицитного фактора в крови, тест восстановления, оценку фармакокинетической кривой (с расчетом периода полувыведения). Для оценки результативности гемостатической терапии возможно проведение интегральных тестов: тромбоэластография, тест генерации тромбина, тромбодинамика в динамическом наблюдении [8].
Профилактическое лечение
Профилактическая заместительная терапия концентратами факторов свертывания крови – необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией.
Профилактика заключается в систематическом введении факторов свертывания крови с целью предотвращения кровотечений, развития гемофилической артропатии и инвалидности.
Существует 4 вида профилактики (табл.4). Профилактическая терапия, которая начинается при отсутствии признаков повреждения суставов, до трехлетнего возраста и хотя бы до второго эпизода гемартроза называется первичной.
Первичная профилактика является наиболее эффективной для предотвращения поражения опорно-двигательного аппарата. Решение о начале постоянной профилактической заместительной терапии необходимо принимать с учетом состояния венозного доступа. При необходимости может решаться вопрос об установке центрального венозного катетера [10].
Пациентам с частыми повторяющимися кровоизлияниями в суставы (особенно в суставы-мишени) рекомендовано проводить вторичную или третичную профилактику [11]. Профилактическая терапия не устраняет уже развившееся повреждение сустава, но уменьшает частоту кровотечений и может замедлить прогрессирование заболевания суставов и улучшить качество жизни.
Таблица 4. Виды профилактики при гемофилии
Вторичная профилактика начинается после двух или более гемартрозов при наличии минимальных признаков повреждения сустава. Третичная профилактика назначается в любом возрасте при наличии повреждения сустава/суставов. Может быть постоянной или краткосрочной (периодической).
Показаниями для проведения постоянной профилактической заместительной терапии являются: тяжелая форма гемофилии, среднетяжелая форма гемофилии при развитии хотя бы одного эпизода гемартроза или выраженных геморрагических проявлений другой локализации. Пациентам с активностью фактора более 3% постоянное или длительное профилактическое лечение необходимо при повторных кровоизлияниях в суставы, появлении признаков синовиита или артропатии, выраженных геморрагических проявлениях, требующих частых введений концентратов факторов свертывания.
Профилактическое введение препарата лучше проводить утром, чтобы максимальные уровни фактора в крови были в период наибольшей активности. Протокол проведения профилактической терапии должен быть по возможности индивидуализированным, с учетом возраста, венозного доступа, фенотипа кровотечений, базовой активности дефицитного фактора, физической и социальной активности пациента, коморбидности и особенностей фармакокинетической кривой.
Существуют различные модели профилактики, основные из которых представлены в табл. 5. Наиболее часто используется шведская модель профилактики: инфузия препарата FVIII в дозе 20-40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю пациентам с ГА и FIX в дозе 25-40 МЕ/кг 1 раз в 3 дня или 2 раза в неделю пациентам с ГВ.
Таблица 5. Основные модели профилактического лечения
* Переход к следующему шагу при развитии 3 кровотечений в один сустав или 4 кровотечений в суставы/мышцы за 3 месяца, либо 5 кровотечений в один сустав независимо от времени.
** Переход к следующему шагу при развитии спонтанного гемартроза.
У детей раннего возраста при наличии сложности с венозным доступом рекомендовано начинать терапию с введения более высоких доз, например, 50–70 МЕ/кг 1 – 2 раза в неделю для пациентов с ГА и 1 раз в неделю для пациентов с ГВ. По мере роста пациента и возможного ухудшения клинического фенотипа заболевания с учащением возникновения геморрагического синдрома частота введения должна увеличиваться, а разовая доза снижаться до средних терапевтических значений [9, 10].
При профилактической терапии рекомендуется проведение клинического и лабораторного контроля.
При клиническом контроле решение о недостаточной эффективности профилактической терапии принимается в следующих случаях: более двух эпизодов спонтанных гемартрозов в год, появление признаков хронического синовиита или артропатии, возникновение спонтанных геморрагических проявлений другой локализации. Лабораторный контроль заключается в определении остаточной активности фактора перед следующим введением (должна быть не ниже 1%), контроле наличия ингибитора, и, по возможности, в проведении фармакокинетического исследования [12].
Причинами недостаточно эффективной заместительной профилактической терапии могут быть:
- появление ингибитора к фактору свертывания крови,
- слишком низкая дозы и/или кратность введения;
- несоблюдение режима и доз введения пациентом или его родителями;
- индивидуальные особенности пациента, требующие применения более высоких доз или более частого введения препарата.
При наличии клинических или лабораторных данных о неэффективности профилактической терапии принимается решение о повышении дозы или кратности введения препарата. Учитывая, что основная задача профилактической заместительной терапии – сохранение качества жизни пациента, у пациентов с высоким уровнем физической активности допустимо повышение стандартных доз или увеличение кратности введения препарата.
Особенности проведения гемостатической терапии в зависимости от локализации кровотечения
Гемартрозы и кровоизлияния в мышцы
Заместительную терапию рекомендовано начинать как можно быстрее, как только пациент ощутил первые субъективные симптомы: боль, чувство распирания, дискомфорт, нарушение функции.
Кровоизлияния в суставы проявляются дискомфортом, болью, нарушением функции, флюктуацией. Гематомы, как и гемартрозы, сопровождаются болевым синдромом, нарушением функции конечности. Кровоизлияния наиболее опасны в участках, где они могут нанести ущерб нервно-сосудистой системе (например, подвздошная, икроножная мышцы). При развитии выраженного болевого синдрома возможно проведение кратковременной иммобилизации, которая должна сниматься сразу после прекращения болей. При болевом синдроме показано использование местной гипотермии на 15 – 20 минут каждые 4 – 6 часов только в течение первых суток.
Реабилитационные мероприятия и ЛФК целесообразно начинать после прекращения болевого синдрома с учетом состояния места повреждения. Если пациент не получает постоянное профилактическое лечение, после купирования кровотечения показана кратковременная профилактика, особенно на время реабилитации [4, 6, 9].
Пункции сустава с аспирацией содержимого показаны при: гемартрозе с болевым синдромом, при наличии большого объема крови в полости сустава, при признаках развития гнойного артрита, развитии на фоне гемартроза нервно-мышечных нарушений.
Кровоизлияния в ЦНС
Заместительную терапию рекомендовано начинать при подозрении на кровоизлияние в ЦНС до проведения диагностики. Любая черепно-мозговая травма у пациентов с гемофилией может вызвать внутричерепное кровоизлияние. Травма спины может привести к кровоизлиянию в спинномозговой канал. Возможны также спонтанные кровоизлияния в ЦНС. Признаками внутричерепного кровоизлияния могут быть: сохраняющаяся и нарастающая головная боль, сонливость, немотивированное беспокойство или заторможенность, повторная рвота или срыгивание, другая очаговая или общая неврологическая симптоматика.
У детей первых месяцев жизни возможны кровоизлияния с минимальными симптомами или бессимптомные. Даже минимальные кровоизлияния в ЦНС являются жизнеугрожающими, требуют экстренной госпитализации, интенсивной заместительной терапии и незамедлительного проведения КТ или МРТ головного мозга [2, 6, 13].
Решение о проведении инвазивного вмешательства у взрослых пациентов с кровоизлиянием в ЦНС принимается коллегиально с учетом сопутствующих заболеваний.
После кровоизлияния в ЦНС рекомендована обязательная профилактическая терапия в течение 3—6 месяцев.
Кровотечения из ЖКТ
При подозрении на кровотечение из ЖКТ рекомендуется незамедлительно начинать заместительную терапию фактором свертывания.
Острые кровотечения из ЖКТ могут проявляться кровавой рвотой, рвотой с прожилками крови или «кофейной гущей», кровянистым стулом или меленой. Характерны резкая слабость, учащение пульса, падение АД, сухость во рту, бледность кожи.
Кровотечения из ЖКТ развиваются, как правило, на фоне сопутствующей патологии ЖКТ: язвенная болезнь, эрозии, полипы, воспалительные заболевания кишечника и др. Такие кровотечения являются жизнеугрожающими и требуют экстренной госпитализации и немедленного проведения адекватной заместительной терапии. Необходимо срочно установить источник кровотечения, для чего проводятся гастроскопия, колоноскопия, УЗИ, рентгенологическое исследование ЖКТ с барием.
Помимо заместительной терапии, показана терапия ингибиторами фибринолиза и лечение местного процесса, приведшего к развитию кровотечения. Следует регулярно проводить общий анализ крови и, по мере необходимости, лечение анемии [2, 6, 13].
Почечные кровотечения
Помимо заместительной терапии, рекомендовано соблюдение постельного режима и проведение гидратации (3 л/м2) в первые 48 часов. Не рекомендуется применение ингибиторов фибринолиза. Дополнительное возможно назначение преднизолона. Пациентам, у которых развилось почечное кровотечение, необходимы консультация уролога и урологическое обследование. [3, 4, 8, 14]
Лечение ингибиторной гемофилии
Общая информация
Появление ингибитора к FVIII/FIX считается самым тяжелым осложнением, связанным с лечением гемофилии. Ингибиторы – алло-антитела (IgG), которые нейтрализуют экзогенные FVIII/FIX.
Появление ингибитора в основном проявляется отсутствием клинического ответа на стандартную терапию концентратами факторов свертывания или появлением кровотечений на профилактической терапии.
Наиболее часто ингибиторы появляются у пациентов с тяжелой формой гемофилии (до 30% пациентов с тяжелой формой ГА и до 3-5% пациентов с тяжелой формой ГВ). Наиболее часто ингибитор развивается в первые 50 (100) дней введения (ДВ) фактора и после интенсивной терапии при хирургическом вмешательстве.
При тяжелой форме гемофилии появление ингибитора не влияет на количество и локализацию кровотечений. Но поскольку при появлении ингибиторов заместительная терапия факторами становится неэффективной, риск тяжелых осложнений и даже смерти от кровотечения у этих больных выше.
При умеренной или легкой гемофилии ингибитор может нейтрализовать эндогенный FVIII/FIX, тем самым преобразуя клинический фенотип заболевания в тяжелую форму.
При ингибиторной ГВ до 50% пациентов могут иметь тяжелые аллергические реакции, в том числе анафилаксию, при применении FIX. Такие реакции часто бывают первым симптомом развития ингибитора [15].
Диагностика наличия ингибитора
Рекомендовано использование метода Бетезда в модификации Нимегена, единицы измерения – единицы Бетезда (БЕ) и подтверждение диагноза путем повторного определения ингибитора с интервалом в 1 неделю. Диагноз ингибиторной гемофилии устанавливается при титре ингибитора ≥ 0,6 БЕ [4, 12].
Подтверждение наличия ингибитора и определение его титра выполняется в коагулологической лаборатории. У детей оценка наличия ингибитора должна проводиться каждые 5 дней первые 20 ДВ, каждые 10 дней с 21 до 50-й ДВ, а затем не менее 2 раз в год до 100 ДВ. У пациентов с более чем 100 ДВ препарата оценка наличия ингибитора должна проводиться 1 раз в год и дополнительно в следующих ситуациях: снижение эффективности заместительной терапии факторами при введении адекватных доз, появление или увеличение количества кровотечений на профилактической терапии, отсутствие достаточного повышения уровня фактора в крови после введения препарата. Кроме того, диагностика ингибитора также должна проводиться в следующих ситуациях:
— при смене препарата (через 10-20 ДВ и через 6 месяцев терапии);
— перед хирургическими вмешательствами и после операции при отсутствии адекватного повышения уровня фактора в крови после введения препарата;
— через 4 недели после окончания проведения интенсивной терапии.
Классификация ингибиторов:
— титр ингибитора < 5 БЕ — ингибитор в низком титре (низкореагирующий);
— титр ингибитора ≥ 5 БЕ — ингибитор в высоком титре (высокореагирующий).
Ингибиторы в низком титре могут иметь транзиторный характер и исчезать в течение 6 месяцев. Ингибиторы в высоком титре обычно носят постоянный характер. При длительном отсутствии заместительной терапии их титр может снизиться, но при возобновлении терапии через 3-5 дней может развиться анамнестическая реакция.
При очень низком титре (< 0,6 БЕ) ингибитор может не выявляться при исследовании методом Бетезда, но может обуславливать укорочение периода полувыведения и восстановления фактора [16].
Лечение по требованию и профилактика при наличии ингибитора
У пациентов с низким титром ингибитора кровотечение рекомендовано купировать введением концентрата фактора свертывания крови в дозах, превосходящих стандартные в 3 раза. При отсутствии эффекта необходимо применение препаратов шунтирующего действия. Выбор препарата для лечения должен основываться на титре ингибитора, клиническом ответе на терапию и характере кровотечения.
Купирование кровотечений у пациентов с высоким титром ингибитора рекомендовано проводить лечение только препаратами шунтирующего действия [9].
В настоящее время существуют 2 группы шунтирующих препаратов: антиингибиторный коагулянтный комплекс (АИКК) и активированный рекомбинантный фактор VII (эптаког альфа (активированный)). Достоверной разницы в эффективности, безопасности и стоимости лечения этими препаратами не получено. Однако имеются данные об индивидуальных особенностях ответа пациента на каждый из препаратов, что необходимо учитывать при выборе препарата.
Дозы препаратов с шунтирующим механизмом действия для купирования кровотечения:
— АИКК назначается в дозе 50 – 100 Ед/кг каждые 12 часов. Максимальная суточная доза 200 Ед/кг;
— эптаког альфа (активированный) назначается в дозе 90 – 120 мкг/кг каждые 2 – 4 часа до остановки кровотечения. Возможно однократное введение в сутки в дозе 270 мкг/кг.
При ингибиторной гемофилии возможно проведение профилактической терапии. Длительная профилактическая терапия проводится АИКК в различных режимах:
— при проведении индукции иммунологической толерантности (ИИТ) в дозе 50–100 Ед/кг каждые 12 часов до снижения титра ингибитора менее 2 БЕ;
— вне ИИТ в дозе 30 – 100 Ед/кг 3 раза в неделю или через день.
Краткосрочную (в течение 3-х месяцев) профилактическую терапию возможно проводить препаратом эптаког альфа (активированным) в режиме 90 мкг/кг 1 раз в сутки [12, 15, 16].
Индукция иммунологической толерантности
У пациентов с ингибиторной формой ГА первой линией терапии рекомендовано проведение ИИТ с целью элиминации ингибитора [12].
Оптимальные сроки начала ИИТ – сразу после выявления ингибитора. Эффективность ИИТ значительно повышается, если в начале терапии титр ингибитора не превышает 10 БЕ. Если титр ингибитора составляет > 10 БЕ, то рекомендуется прекратить инфузии концентрата FVIII, перевести пациента на терапию шунтирующими препаратами и контролировать титр ингибитора. Тем не менее, сохранение высокого титра ингибитора не является противопоказанием к назначению ИИТ.
При проведении ИИТ недопустимо менять препарат концентрата FVIII, поскольку это значительно ухудшает прогноз терапии. Перед проведением ИИТ необходимо убедиться в наличии достаточного количество препарата концентрата FVIII.
Существуют различные протоколы проведения ИИТ (табл.6). Оптимального режима проведения ИИТ нет. Для пациентов с высокореагирующим ингибитором, независимо от титра ингибитора на момент начала ИИТ, рекомендована начальная схема 100 – 150 МЕ/кг FVIII каждые 12 часов. Для пациентов с низкореагирующим ингибитором рекомендовано начинать ИИТ по схеме 50 – 100 МЕ/кг FVIII ежедневно или каждый второй день.
Таблица 6. Протоколы проведения ИИТ
Снижение дозы и кратности введения препарата начинается после достижения следующих показателей: титр ингибитора — менее 0,6 БЕ, нормализация теста восстановления (более 70%) и нормализация периода полувыведения (более 7 часов). Дозу препарата снижают постепенно по схеме с постоянным лабораторным контролем. После достижения дозы в 30 – 50 МЕ/кг 1 раз в 2 дня необходимо длительно продолжать терапию в этой дозе в режиме вторичной/третичной профилактики. Отмена профилактического лечения часто приводит к рецидиву ингибитора. Максимальная длительность ИИТ 3 года. Критерии эффективности ИИТ представлены в таблице 7.
Таблица 7. Критерии эффективности ИИТ
Препарат для проведения ИИТ подбирают индивидуально на основании результатов фармакокинетического исследования.
При проведении ИИТ необходимо избегать любых воздействий и препаратов, стимулирующих иммунные реакции, в том числе вакцинации, применения препаратов интерферона и других видов иммунотерапии.
Для купирования геморрагического синдрома вовремя ИИТ рекомендовано применение препаратов с шунтирующим механизмом действия: АИКК и эптаког альфа (активированный) [15, 16].
При отсутствии тенденции к снижению ингибитора в течении 12 месяцев от начала высокодозной терапии рекомендовано прекратить ИИТ и перевести пациента на терапию шунтирующими препаратами. Возможно повторное проведение ИИТ с использованием другого препарата или изменением режима терапии.
Опыт проведения ИИТ у пациентов с ингибиторной ГB ограничен. Это обусловлено очень низкой эффективностью и наличием аллергических реакций.
Ортопедическое лечение
У большинства пациентов с гемофилией вследствие рецидивирующих гемартрозов формируются различные повреждения опорно-двигательного аппарата.
Хронический синовиит
При развитии хронического синовиита рекомендовано проведение профилактической заместительной терапии концентратом фактора в режиме, который позволит предотвратить развитие спонтанных гемартрозов. Важно также выполнение ежедневных упражнений (ЛФК), направленных на укрепление мышц и поддержание подвижности сустава [3, 8, 11].
Хронический синовиит развивается после повторных гемартрозов. Как правило, он обусловлен отсутствием или недостаточной эффективностью заместительной терапии. Проявляется длительно сохраняющимся повышением температуры над пораженным суставом, увеличение объема мягких тканей в области сустава, рецидивирующими кровоизлияниями, ограничением подвижности.
Диагностика включает выявление клинических признаков, УЗИ и/или МРТ суставов. Терапия проводится совместно с ортопедами, имеющими опыт лечения больных гемофилией. При сохранении признаков воспаления показана терапия нестероидными противовоспалительными препаратами (ингибиторами COX-2).
При недостаточной эффективности заместительной терапии возможно проведение курса пункций сустава с введением стероидных противовоспалительных препаратов (на первом этапе); далее вариантами выбора являются химическая или эндоскопическая синовэктомия, а при их недостаточной эффективности – хирургическая коррекция.
Хроническая деформирующая артропатия
Терапию рекомендовано проводить совместно с ортопедами, имеющими опыт лечения больных гемофилией.
Хроническая деформирующая артропатия возникает вследствие прогрессирующего течения хронического синовиита и рецидивирующих кровоизлияний в суставы. Проявляется остеопорозом, нарушением структуры, истончением и потерей суставного хряща, болевым синдромом, контрактурами, мышечной атрофией, деформацией сустава.
Основой профилактики развития хронической артропатии является адекватная постоянная профилактическая заместительная терапия. Своевременное лечение синовиита также необходимо для предотвращения развития артропатии. Диагностика артропатии основана на выявлении клинических признаков и на результатах инструментальных исследований: УЗИ, КТ, МРТ [8].
Целью лечения уже развившейся хронической артропатии является улучшение функционирования сустава и уменьшение болевого синдрома. Для борьбы с болевым синдромом оптимально использовать ингибиторы COX-2. Для восстановления функции сустава, состояния мышц проводят курсы ЛФК и физиотерапии. В ряде случаев эффективно использование тренажеров. На начальных этапах восстановительного лечения показано проведение курсов препаратов гиалуроновой кислоты. При недостаточной эффективности консервативной терапии показано хирургическое лечение, которое должно проводиться врачами, имеющими опыт лечения пациентов с гемофилией.
Псевдоопухоли
Псевдоопухоли формируются вследствие неправильной терапии кровоизлияний в мягкие ткани, обычно в мышцы, расположенные рядом с костью, которая может быть затронута вторично, или при поднадкостничных кровоизлияниях. Проявлениями псевдоопухоли являются стабильное опухолевидное образование, оттесняющее окружающие ткани, которое существует на протяжении многих месяцев или лет и не имеет тенденции к обратному развитию на фоне интенсивной заместительной терапии факторами. При отсутствии лечения псевдоопухоль может достигать гигантских размеров, создавая давление на нейроваскулярные структуры и вызывая патологические переломы.
Диагностика псевдоопухоли включает физикальное обследование, проведение рентгенографии, КТ или МРТ пораженного сегмента тела.
Лечение рекомендовано проводить совместно хирургами и гематологами. На первом этапе возможна попытка интенсивной заместительной терапии в течение 6 – 8 недель с последующим контролем посредством МРТ. Если образование не имеет тенденции к обратному развитию, рекомендовано тотальное удаление опухоли с иссечением капсулы [3, 6]. Операция должна проводиться специалистами, имеющими опыт хирургического ортопедического лечения больных гемофилией.
Переломы
При развитии перелома рекомендовано незамедлительное начало заместительной терапии концентратом факторов свертывания. В течение первых 3-5 дней необходимо поддержание уровня фактора в крови не менее 50-100% (в зависимости от локализации и тяжести травмы). Постоянная заместительная терапия фактором должна проводиться в течение 10-14 дней [6].
Риск развития переломов у пациентов с гемофилией связан с остеопорозом и гемофилической артропатией. Сразу после стабилизации перелома следует приступить к проведению восстановительной терапии.
Оперативное лечение
Любое оперативное вмешательство или проведение инвазивной процедуры рекомендовано проводить под прикрытием заместительной терапии концентратами факторов свертывания крови.
У больных с гемофилией хирургическое вмешательство может потребоваться для лечения как осложнений гемофилии, так и не связанных с гемофилией заболеваний. Перед любым хирургическим вмешательством необходима консультация в центре лечения гемофилии. Если есть возможность, оперативное лечение лучше проводить в специализированном стационаре. Оперативное вмешательство у пациентов с ингибиторной гемофилией должно проводиться только в условиях специализированного стационара. Анестезиолог должен иметь опыт лечения пациентов с нарушениями свертываемости крови [4, 6, 8, 17].
Необходим строгий мониторинг коагулограммы, активности фактора и скрининг на наличие ингибитора. Дозы и продолжительность терапии концентратом фактора свертывания крови зависят от типа оперативного вмешательства (таблица 3).
При необходимости проведения таких диагностических процедур, как люмбальная пункция, пункция артерии, эндоскопическое исследование с биопсией, ведение пациента такое же, как при хирургическом лечении.
Иное лечение
Для остановки кровотечений/кровоизлияний у пациентов с гемофилией рекомендована дополнительная гемостатическая терапия. В качестве дополнительной гемостатической терапии возможно использование следующих лекарственных препаратов [2, 4, 9]:
- Десмопрессин (DDAVP). Применение десмопрессина может поднимать активность FVIII у пациентов с легкой ГА. Препарат вводится внутривенно или подкожно в разовой дозе 0,3 мкг/кг. Возможно использование специального назального спрея. Разовая доза — 300 мкг. Следует избегать применения десмопрессина у детей до 4 лет и у пациентов старше 60 лет. Препарат вводится однократно, при повторном введении через короткий промежуток времени возможно развитие тахифилаксии. Имеется большая индивидуальная вариабельность ответа на введение DDAVP, поэтому, перед его назначением, для оценки индивидуальной реакции, необходимо выполнить тест восстановления (анализ активности FVIII до и через 1 час после введения терапевтической дозы Длительность терапии DDAVP у детей не должна превышать 1 – 2 дней [18, 19].
- Ингибиторы фибринолиза. Используются как дополнение к специфической заместительной терапии. Наиболее эффективны при кровотечениях из ран слизистых оболочек. Могут использоваться для лечения кровотечений других локализаций. Запрещено использовать при почечных кровотечениях.
- Местные гемостатические препараты. При проведении оперативных вмешательств, особенно на паренхиматозных органах, при экстракции зубов, лечении ран показано использование местных гемостатических препаратов. Эти препараты применяются совместно с заместительной терапией и призваны оптимизировать местный гемостатический эффект.
Стоматологическая помощь
Для больных гемофилией важно соблюдение гигиены полости рта, что помогает предотвратить развитие пародонтоза и кариеса. Для чистки зубов необходимо использовать мягкую зубную щетку. Плановые стоматологические осмотры должны проводиться не менее 2 раз в год. Обычные осмотры стоматолога и чистка зубов могут проводиться без заместительной терапии факторами. Однако необходимо иметь в свободном доступе гемостатические препараты (концентраты факторов VIII/IX, DDAVP, антифибринолитические препараты).
Проведение местной анестезии у пациентов с тяжелой и среднетяжелой формами гемофилии рекомендуется только после введения концентрата фактора свертывания. При легкой форме гемофилии введение концентрата фактора свертывания не является обязательным, у этой группы пациентов может быть использована терапия DDAVP [18, 19].
При оказании стоматологической помощи важно тесное взаимодействие хирурга-стоматолога и гематолога. Удаление зуба или хирургические процедуры рекомендовано выполнять под строгим контролем гемостаза и после консультации.
При проведении стоматологических процедур возможно применение транексамовой кислоты или других антифибринолитических препаратов с целью снижения потребности в заместительной терапии концентратом фактора. Возможно использование местных гемостатических препаратов после удаления зубов. При обширных стоматологических процедурах (наложение швов, множественная экстракция зубов) может понадобиться госпитализация пациента в стационар [10].
Следует воздержаться от применения НПВП, особенно ацетилсалициловой кислоты.
Особого внимания требует профилактика во время стоматологических процедур у пациентов с ингибиторной формой гемофилии.
Гемофилия у новорожденных
При решении вопроса о способе родоразрешения (вагинальное или оперативное), если ожидается рождение ребенка с гемофилией, необходимо выбрать наиболее атравматичный способ. Вакуумэкстракция является опасной и не должна проводиться в отношении плодов, у которых подозревается гемофилия. После родоразрешения желательно отобрать образец пуповинной крови в пробирку с цитратом натрия для определения активности факторов свертывания крови. При оценке результатов необходимо учитывать возрастные особенности. До момента диагностики у новорожденных с предполагаемой гемофилией желательно воздержаться от венепункций (исключая диагностику гемофилии), отбора образцов капиллярной крови и других инвазивных манипуляций [6].
Вакцинация
Пациенты с гемофилией могут быть вакцинированы. Особенно важно проведение вакцинации от гепатита В. При вакцинации предпочтение отдается оральному или подкожному введению препарата по сравнению с внутримышечным или внутрикожным. Если для данной вакцины доступен только внутримышечный путь введения, то необходима заместительная терапия факторами свертывания крови для предотвращения развития гематомы. В этом случае заместительную терапию проводят накануне вакцинации. В день вакцинации введение препарата не рекомендуется. Нельзя проводить вакцинацию во время кровотечения [3, 4, 8].
Проведение лабораторных исследований
Лабораторные анализы лежат в основе диагностики и контроля у пациентов с гемофилией. Требования к условиям и технике отбора образцов и выполнения исследований не отличаются от стандартных. Важным аспектом лабораторных исследований является участие в системе контроля качества. При диагностике гемофилии оптимально участвовать не только в государственной, но и в международной системе контроля качества лабораторных исследований, охватывающей основные коагулологические параметры [5].
Нежелательная медикаментозная терапия.
Больным с гемофилией не рекомендовано применение препаратов, ухудшающих функцию тромбоцитов или свертывания крови. Применение таких препаратов может привести к развитию тяжелых кровотечений, которые не купируются введением концентратов факторов свертывания крови. Однако развившийся тромбоз может потребовать применения антикоагулянтов. Предпочтение надо отдавать препаратам кратковременного действия. Каждый раз необходимо анализировать соотношение пользы и риска от применения антикоагулянтов и антиагрегантов.
Особенности ведения больных гемофилией
Гарантированное бесперебойное обеспечение концентратами FVIII и FIX у пациентов с неосложненной гемофилией или препаратами «шунтирующего действия» у пациентов с ингибиторной формой гемофилии, обучение применению этих препаратов членов семьи больных гемофилией является приоритетом в организации помощи больным гемофилией [9].
При лечении кровотечений необходимо придерживаться следующих принципов:
1. Для остановки кровотечений должна применяться заместительная терапия концентратами FVIII или FIX, либо препаратами «шунтирующего действия» у пациентов с ингибиторной формой гемофилии.
2. Необходимо сразу применять эффективные дозы концентратов факторов свертывания или препаратов «шунтирующего действия». Терапия недостаточными дозами не позволит остановить кровотечение, приведет к потере времени, нарастанию геморрагического синдрома и необоснованному расходу дорогостоящего препарата.
3. Гемостатическую терапию (введение концентратов факторов свертывания крови) необходимо начинать как можно раньше (в максимально сжатые сроки настолько насколько это возможно, желательно в течение первых 2-х часов после получения травмы или появления первых субъективных или объективных признаков кровоизлияния). Поэтому основанием для начала терапии могут быть субъективные ощущения пациента или факт травмы. Введение препарата должно быть выполнено обязательно. Необходимо стремиться остановить кровотечение или кровоизлияние до развития значимых клинических проявлений. При наличии травмы пациент должен быть осмотрен гематологом в обязательном порядке.
4. Лечение легких и средних кровотечений должно проводиться на дому пациентом или его родственниками в соответствии с рекомендациями гематолога. При развитии тяжелого кровотечения терапия должна быть начата как можно раньше (на дому) и продолжена под наблюдением гематолога стационарно или амбулаторно.
5. Пациенты не должны использовать препараты, нарушающие функцию тромбоцитов и угнетающие свертывание крови, особенно ацетилсалициловую кислоту и др. НПВП (за исключением некоторых ЦОГ-2: кеторолака, нимесулида, ибупрофена, целекоксиб, парекоксиб и др.).
6. Следует избегать внутримышечных инъекций и пункции артерий.
7. Следует поощрять регулярные занятия физическими упражнениями, способствующими развитию мускулатуры, защите суставов и улучшению физического состояния (например, лечебная гимнастика, плавание, терренкур).
8. Пациенты должны избегать ситуаций, связанных с высоким риском травм, в том числе занятия контактными видами единоборств, игр с тяжелым мячом, занятий на спортивных снарядах, и т.д.
Обучение пациентов и членов их семей
Обучение пациентов и членов их семей – необходимое условие обеспечения адекватной помощи таким больным. Обучение начинается сразу после установления диагноза и проводится на постоянной основе врачами и медицинскими сестрами центра, в котором наблюдается пациент. Обучение проводится индивидуально при посещении центра и в рамках школы больных гемофилией [13].
Основные направления обучения пациента и членов его семьи:
- что такое гемофилия;
- особенности детей, больных гемофилией;
- навыки оценки состояния ребенка;
- навыки оценки симптомов, характера и тяжести кровотечения;
- хранение и использование концентратов факторов свертывания крови;
- показания и дозы заместительной терапии;
- навыки проведения инфузии в домашних условиях;
- уход за венами;
- применение других гемостатических препаратов;
- физическая активность;
- психологическая и социальная адаптация;
- профессиональная ориентация;
- юридические аспекты.
Помимо врачей и медсестер к обучению пациентов и членов их семей необходимо привлекать психологов, юристов и членов общественных организаций, представляющих интересы больных гемофилией.
Медицинская реабилитация
Реабилитация
Пациентам с поражением элементов опорно-двигательного аппарата рекомендовано долгосрочное лечение повреждений суставов и мышц, и функциональная реабилитация. Этим пациентам рекомендуется санаторно-курортное лечение с целью предотвращения прогрессирования нарушений опорно-двигательного аппарата и улучшения их ортопедического статуса [8, 14, 17].
Основным клиническим проявлением гемофилии являются рецидивирующие кровоизлияния в суставы, что необратимо приводит к развитию деформирующей артропатии и хронического синовита у этих пациентов. Поражение опорно-двигательного аппарата существенно лимитирует социальную адаптированность пациентов, ухудшает их качество жизни. Лечение можно проводить в санаторно-курортных организациях в климатической зоне проживания пациента, а также на бальнеологических курортах. Разработка реабилитационных мероприятий должна проводиться совместно специалистами по реабилитации, курортологии и гематологами, имеющими опыт лечения пациентов с нарушениями свертывания крови.
Возможны такие виды физиотерапии, как:
- воздействие ультразвуком при заболеваниях суставов;
- лекарственный ультрафонофорез при заболеваниях суставов;
- электрофорез лекарственных препаратов при заболеваниях суставов;
- воздействие высокочастотными электромагнитными полями (индуктотермия);
- воздействие электрическим полем ультравысокой частоты (ЭП УВЧ);
- воздействие переменным магнитным полем (ПеМП).
Пациентам с гемофилией и членам их семьи целесообразно проведение школ психологической адаптации.
Профилактика
Профилактика и диспансерное наблюдение
При наличии показаний (рецидивирующие кровоизлияния в суставы, другие угрожающие кровотечения, предстоящее инвазивное лечение и др.) пациентам со среднетяжелой и легкой формами рекомендована профилактическая терапия [9, 10].
Профилактическая терапия концентратами FVIII или FIX, а также препаратами «шунтирующего действия» — основа ведения пациентов с тяжелой формой гемофилии. Профилактическое лечение проводится на дому пациентом или его родственниками.
Ключевыми показателями улучшения состояния и качества жизни больных с гемофилией являются предотвращение развития геморрагического синдрома, регресс или остановка прогрессирования костно-суставных, мышечных дегенеративных изменений и отсутствие спонтанных кровоизлияний.
Всех пациентов с гемофилией рекомендовано регистрировать и наблюдать в специализированном центре. У пациентов или врачей, к которым они обращаются, круглосуточно должна быть возможность контакта с гематологом, имеющим опыт лечения больных с нарушениями гемостаза. Ведение и лечение пациентов с гемофилией проводится группой специалистов различного профиля, включающей гематолога, педиатра, ортопеда, стоматолога, физиотерапевта, врача ЛФК, психолога, имеющих опыт работы с больными гемофилией [13].
Осмотр пациентов гематологом, ортопедом и стоматологом должен проводиться не менее двух раз в год; остальными специалистами — по необходимости. Целесообразно проведение 1 раз в год диспансеризации в специализированном центре, если центр располагает достаточной клинико-лабораторной базой.
Диспансерное наблюдение за пациентами с гемофилией включает:
- оценку наличия нежелательных явлений при проведении заместительной терапии: появление ингибитора к фактору свертывания крови, индивидуальная непереносимость препарата, вирусная контаминация;
- оценку изменения психологического или социального статуса пациента;
- оценку состояния периферической венозной системы;
- лечение осложнений гемофилии: коррекция дефицита железа, ингибиторов;
- выявление и лечение сопутствующих заболеваний, особенно заболеваний зубов, полости рта, ЖКТ, ЛОР-органов, патологии
Информация
Источники и литература
-
Клинические рекомендации Национального гематологического общества
- 1. Баркаган З. С. Введение в клиническую гемостазиологию — М.: Ньюдиамед-АО, 1998
2. Руководство по гематологии в 3 томах / Под ред. А. И. Воробьева. — М.: Ньюдиамед, 2005
3. Протокол ведения больных «Гемофилия». Проблемы стандартизации в здравоохранении 2006; 18—74
4. Guidelines for the management of hemophilia. 2nd edition. Доступно в интернете по адресе www.WFH.org.
5. Момот А. П. Принципы и алгоритмы клинико-лабораторной диагностики. — СПб: Форма Т, 2006
6. Srivastava A, Brewer AK, Mauser-Bunschoten EP et al. Guidelines for the management of hemophilia (WFH). Haemophilia 2013; 19:e1—e47
7. Stonebraker JS, Bolton-Maggs PH, Soucie JM, Walker I, Brooker M. A study of variations in the reported haemophilia A prevalence around the world. Haemophilia 2010;16(1):20-32
8. Canadian Hemophilia Standards Group. Canadian Comprehensive Care Standards for Hemophilia and Other Inherited Bleeding Disorders. First Edition, June2007. Доступно по адресу: http://www.lhsc.on.ca/Health_Professionals/Bleeding_Disorders/comprehensive_care_canada_2008.pdf
9. Richards M, Williams M, Chalmers E at al. A United Kingdom Haemophilia Centre Doctors’ Organization guideline approved by the British Committee for Standards in Haematology: guideline on the use of prophylactic factor VIII concentrate in children and adults with severe haemophilia A. Br J Haematol 2010; 149:498—507
10. Astermark J, Petrini P, Tengborn L et al. Primary prophylaxis in severe haemophilia should be started at an early age but can be individualized. Br J Haematol 1999; 105:1109—1113. 920
11. Nilsson IM, Berntorp E, Lofqvist T et al. Twenty-five years’ experience of prophylactic treatment in severe haemophilia A and B. J Intern Med 1992; 232:25—32
12. Основы клинической гемостазиологии и гемореологии: монография / Под ред. И. Л. Давыдкина, А. П. Момота, Н. И. Зозули, Е. В. Ройтмана. — Самара: ООО ИПК «Самарская Губерния», 2017
13. Ingram GI, Dykes SR, Creese AL et al. Home treatment in haemophilia: clinical, social and economic advantages. Clin Lab Haematol 1979; 1:13—27. 921
14. Colvin BT, Astermark J, Fischer K et al. European principles of. Haemophilia care. Haemophilia 2008; 14:361—374
15. Зозуля Н. И. Диагностика и лечение ингибиторной формы гемофилии. Автореферат дисс. д. м. н. — М., 2010
16. Collins PW, Chalmers E, Daniel P et al. Diagnosis and treatment of factor VIII and IX inhibitors in congenital haemophilia (4th edition). Br J Haematol 2013; 160:153—170.
17. De Moerloose P, Fischer K, Lambert T et al. Recommendations for assessment, monitoring and follow-up of patients with haemophilia. Haemophilia 2012; 18:319—325. 18. Castaman G, Mancuso ME, Giacomelli SH, et al. Molecular and phenotypic determinants of the response to desmopressin in adult patients with mild hemophilia A. J Thromb Haemost 2009;7(11):1824-31
19. Franchini M, Zaffanello M, Lippi G. The use of desmopressin in mild hemophilia A. Blood Coagul fibrinolysis 2010;21(7):615-9
- 1. Баркаган З. С. Введение в клиническую гемостазиологию — М.: Ньюдиамед-АО, 1998
Информация
Коллектив авторов под руководством академика В.Г. Савченко
Авторы:
Зозуля Н.И.1, Кумскова М.А.1, Полянская Т.Ю.1, Свирин П.В.2
Андреева Т.А.3, Васильев С.А.1, Давыдкин И.Л.4, Мамаев А.Н.5, Момот А.П.5, Петров В.Ю.2, Солдатенков В.Е.6
1ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, г. Москва.
2ГБУЗ Морозовской Детской городской клинической больницы ДЗМ г. Москвы
3ГБУЗ «Городская поликлиника №37», г. Санкт-Петербург
4Самарский государственный медицинский университет, г. Самара
5Алтайский филиал ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, г. Барнаул
6ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства» г. Санкт-Петербург
Рекомендации обсуждены на заседании Проблемной комиссии по гематологии (март 2018).
Список сокращений
АД – артериальное давление
АИКК — антиингибиторный коагулянтный комплекс
АЧТВ — активированное частичное тромбопластиновое время
БЕ — Бетезда единица
ГА — гемофилия А
ГВ — гемофилия В
DDAVP — десмопрессин
ДВ — день введения
ЖКТ — желудочно-кишечный тракт
ИИТ — индукция иммунологической толерантности
КТ — компьютерная томография
МКБ-10 – международная классификация болезней 10
МНН – международное непатентованное наименование
МРТ — магнитно-резонансная томография
НПВП — нестероидные противовоспалительные препараты
ПВ — протромбиновое время
ТВ — тромбиновое время
FVIII — фактор свертывания крови VIII
FIX — фактор свертывания крови IX
FXI — фактор свертывания крови XI
FXII — фактор свертывания крови XII
PFA – анализатор функции тромбоцитов (platelet function analyzer)
vWF- фактор Виллебранда
vWF:RCo – ристоцетин-кофакторная активность
vWF:Ag– антиген фактора Виллебранда
ЦНС — центральная нервная система
Алгоритм ведения пациентов с гемофилией
Информация для пациентов
Центры по лечению пациентов с гемофилией:
ФГБУ «НМИЦ гематологии» Минздрава России, отдел коагулопатий. Новый Зыковский проезд, д. 4, г. Москва, 125167. Тел +7 (495) 612 29 12.
ГБУЗ Морозовская ДГКБ ДЗМ, г. Москва, гематологическое отделение. 4-ый Добрынинский пер., д. 1/9, г. Москва, 119049. Тел. +7 (499) 236 15 87.
Городской центр по лечению гемофилии СПб. ГБУЗ «Городская поликлиника № 37». Гороховая ул., д. 6, г. Санкт-Петербург, 191186. Тел. +7 (812) 315 48 71.
НИИ гематологии и трансфузиологии. 2-ая Советская ул., д. 16, г. Санкт-Петербург, 191186. Тел. +7 (812) 274 56 50.
ФГБУ Кировский научно-исследовательский институт гематологии и переливания крови. Красноармейская ул., д. 72, г. Киров, 610027. Тел. +7 (8332) 67 9197
Алтайский филиал ФГБУ «НМИЦ гематологии» Минздрава России. Краевой центр патологии гемостаза. Ляпидевского ул., д. 1, г. Барнаул, 656024. Тел. +7 (3852) 68 98 80.
ИНФОРМИРОВАННОЕ СОГЛАСИЕ БОЛЬНОГО НА ПРОВЕДЕНИЕ ПРОФИЛАКТИЧЕСКОГО ЛЕЧЕНИЯ КОНЦЕНТРАТАМИ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ
я, ____________________________________________________________________
Я согласен, что мое участие в программе профилактического лечения накладывает на меня следующие обязанности:
Проходить все необходимые лабораторные обследования.
Профилактическое лечение проводить строго по рекомендации врача.
Ежемесячно заполнять и сдавать протоколы внутривенного введения факторов свертывания крови.
В случае наступления осложнений или отсутствия клинического эффекта немедленно обращаться
в_*___________________________________________________________________________
В случае невыполнения моих обязанностей, врачебных рекомендаций или обследований мое участие в программе профилактического лечения будет прекращено.
«_____ »__________________ г.
(подпись)
* Название медицинской организации, ее адрес и телефон.
ДОБРОВОЛЬНОЕ ИНФОРМИРОВАННОЕ СОГЛАСИЕ РОДИТЕЛЕЙ (ЗАКОННЫХ ПРЕДСТАВИТЕЛЕЙ) РЕБЕНКА НА ПРОВЕДЕНИЕ ПРОФИЛАКТИЧЕСКОГО ЛЕЧЕНИЯ КОНЦЕНТРАТАМИ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ
я,____________________________________________________________________ ,
(Ф.И.О. полностью, степень родства или статус)
согласен на участие моего ребенка
в программе профилактического лечения концентратами факторов свертывания крови. О возможных побочных реакциях и результатах лечения предупрежден (а). О необходимости соблюдать график наблюдения и лабораторных обследований предупрежден (а).
Я имею возможность вводить этот препарат по месту жительства и ознакомлен (а) с правилами его введения. Я информирован (а) о необходимости:
Своевременно проходить все необходимые лабораторные обследования.
Профилактическое лечение проводить строго по рекомендации врача.
Ежемесячно заполнять и сдавать протоколы внутривенного введения факторов свертывания крови.
В случае наступления осложнений или отсутствия клинического эффекта немедленно обращаться
В___________________________________________________________________________ *
Я информирован (а), что в случае невыполнения этих требований имеется значительный риск развития у моего ребенка тяжелых осложнений.
«___»________________ г.
(подпись)
* Название медицинской организации, ее адрес и телефон.
Протокол гемостатической терапии концентратами факторов свертывания крови за ________________ 200__ года
Ф.И.О. больного_____________________________________________________ Вес_______(кг)
Дата рождения________Тел.____________ Диагноз_______________________
Расчет дозы концентрата, необходимой для введения:
Острые гемартрозы: 1 сустав — 20 МЕкг массы тела
2 и более суставов — 30 МЕ кг массы тела
Гематомы небольших размеров: 20 МЕкг массы тела
Забрюшинные гематомы: 40 МЕ кг массы тела
Подпись лечащего врача
Подпись пациента
ВНИМАНИЕ!
Вводить концентраты факторов свертывания крови необходимо в самом начале кровоизлияния!
Для консультаций звонить по тел. _____________________ (круглосуточно)
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
- 13-04-2018, 12:06
-
- 80
- 1
- 2
- 3
- 4
- 5
- 7
Клинические рекомендации по диагностике и лечению гемофилии
Рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018). Коллектив авторов под руководством академика В.Г. Савченко. Авторы: Зозуля Н.И., Кумскова М.А., Полянская Т.Ю., Свирин П.В. Ссылка на рубрикатор Минздрава http://cr.rosminzdrav.ru/#!/recomend/104
- 16-06-2014, 13:29
-
- 40
- 1
- 2
- 3
- 4
- 5
- 2
Разъяснения к новым стандартам лечения для детей, больных гемофилией и болезнью Виллебранда
К сожалению, в связи с принятием новых стандартов лечения детей с гемофилией и болезнью Виллебранда у врачей-гематологов возникли вопросы в определении необходимых дозировок факторов свертывания крови при составлении заявки на 2015 год. В связи с этим по просьбе МЗ РФ главный детский гематолог МЗ РФ А.Г. Румянцев подготовил письмо с необходимыми разъяснениями. Разъяснение Дополнительное разъяснение
- 15-07-2013, 15:39
-
- 100
- 1
- 2
- 3
- 4
- 5
- 1
Приказ Минздрава России от 24.12.2012 N 1499н
«Об утверждении стандарта первичной медико-санитарной помощи детям при болезни Виллебранда, кровотечении или кровоизлиянии любой локализации» (Зарегистрировано в Минюсте России 21.03.2013 N 27809) текст приказа
- 15-07-2013, 15:34
-
- 0
- 1
- 2
- 3
- 4
- 5
- 0
Приказ Минздрава России от 24.12.2012 N 1495н
«Об утверждении стандарта первичной медико-санитарной помощи детям при гемофилии A, элиминации ингибитора (антител) к фактору свертывания крови VIII — индукция иммунной толерантности» (Зарегистрировано в Минюсте России 20.03.2013 N 27787) текст приказа
- 15-07-2013, 15:29
-
- 0
- 1
- 2
- 3
- 4
- 5
- 0
Приказ Минздрава России от 20.12.2012 N 1242н
«Об утверждении стандарта специализированной медицинской помощи детям при болезни Виллебранда (оперативное лечение)» (Зарегистрировано в Минюсте России 05.03.2013 N 27460) текст приказ
- 15-07-2013, 15:24
-
- 0
- 1
- 2
- 3
- 4
- 5
- 0
Приказ Минздрава России от 20.12.2012 N 1238н
«Об утверждении стандарта первичной медико-санитарной помощи детям при гемофилии A, гемофилии B (профилактике кровотечений или кровоизлияний при неосложненном течении и после успешной индукции иммунной толерантности)» (Зарегистрировано в Минюсте России 19.02.2013 N 27187) текст приказа
- 15-07-2013, 15:20
-
- 0
- 1
- 2
- 3
- 4
- 5
- 0
Приказ Минздрава России от 20.12.2012 N 1237н
«Об утверждении стандарта первичной медико-санитарной помощи детям при гемофилии A, гемофилии B, болезни Виллебранда, редких геморрагических коагулопатиях и тромбоцитопатиях, протромботических состояниях, плановая первичная диагностика» (Зарегистрировано в Минюсте России 06.03.2013 N 27538) текст приказа
- 15-07-2013, 14:40
-
- 100
- 1
- 2
- 3
- 4
- 5
- 2
Приказ Минздрава России от 20.12.2012 N 1235н
«Об утверждении стандарта первичной медико-санитарной помощи детям при гемофилии A, гемофилии B, профилактике кровотечений и кровоизлияний при наличии ингибиторов к факторам свертывания крови VIII или IX» (Зарегистрировано в Минюсте России 07.03.2013 N 27562) текст закона
- 13-06-2012, 15:48
-
- 20
- 1
- 2
- 3
- 4
- 5
- 3
Постановление Правительства РФ от 26 апреля 2012 г. N 404
Об утверждении правил ведения федерального регистра лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей. текст документа
- Research article
- Open Access
- Published: 07 June 2010
- Francesco Baudo2,
- Angela Huth-Kühne3,
- Jørgen Ingerslev4,
- Craig M Kessler5,
- Maria E Mingot Castellano6,
- Midori Shima7,
- Jean St-Louis8 &
- …
- Hervé Lévesque9
BMC Research Notes
volume 3, Article number: 161 (2010)
Cite this article
-
15k Accesses
-
125 Citations
-
7 Altmetric
-
Metrics details
Abstract
Background
Acquired hemophilia A (AHA) is a rare bleeding disorder caused by an autoantibody to coagulation factor (F) VIII. It is characterized by soft tissue bleeding in patients without a personal or family history of bleeding. Bleeding is variable, ranging from acute, life-threatening hemorrhage, with 9-22% mortality, to mild bleeding that requires no treatment. AHA usually presents to clinicians without prior experience of the disease, therefore diagnosis is frequently delayed and bleeds under treated.
Methods
Structured literature searches were used to support expert opinion in the development of recommendations for the management of patients with AHA.
Results
Immediate consultation with a hemophilia center experienced in the management of inhibitors is essential to ensure accurate diagnosis and appropriate treatment. The laboratory finding of prolonged activated partial thromboplastin time with normal prothrombin time is typical of AHA, and the diagnosis should be considered even in the absence of bleeding. The FVIII level and autoantibody titer are not reliable predictors of bleeding risk or response to treatment. Most patients with AHA are elderly; comorbidities and underlying conditions found in 50% of patients often influence the clinical picture. Initial treatment involves the control of acute bleeding with bypassing agents. Immunosuppressive treatment to eradicate the FVIII inhibitor should be started as soon as the diagnosis is confirmed to reduce the time the patient is at risk of bleeding.
Conclusions
These recommendations aim to increase awareness of this disorder among clinicians in a wide range of specialties and provide practical advice on diagnosis and treatment.
Background
Acquired hemophilia A (AHA) is a bleeding disorder caused by an autoantibody to factor VIII [1–4]. It must be distinguished from congenital hemophilia, which is an inherited disorder caused by mutations in the FVIII gene that presents at a young age and is characterized by a distinct bleeding phenotype. AHA has an estimated incidence of 1.5/million/year and predominantly affects older patients [5–7]. The disorder presents with bleeding, ranging from life- and limb-threatening to mild in patients with no personal or family history of bleeding, and has a high mortality, estimated at between 9-22% [5, 8].
Patients usually present to physicians who are not specialists in the field and have not previously managed a case, typically geriatricians, obstetricians, rheumatologists, oncologists, emergency physicians, intensive care physicians or surgeons as well as hematologists. Lack of familiarity with the disorder may lead to delayed diagnosis and suboptimal treatment, therefore immediate consultation with a hemophilia centre experienced in the management of inhibitors is required, irrespective of the clinical features at presentation [9, 10]. The clinical phenotype does not correlate with the factor VIII level or inhibitor titer [1, 5], and patients remain at risk of spontaneous, life-threatening bleeding until the inhibitor has been eradicated [5], even if the initial presentation is associated with mild or no bleeding. The age of the patients and associated comorbidities [11] often influence the clinical phenotype and the risk of treatment-induced side effects [1].
There is no high-level evidence to support management recommendations for patients with AHA. Some data generated in patients with congenital hemophilia can be used to support treatment decisions, however, most treatment recommendations rely on the clinical experience of physicians who have managed patients with the disorder [10]. This guideline is intended to increase the awareness of this rare but often fatal disorder among health care professionals to whom patients with AHA usually present. Clinicians who require more detailed management guidelines are referred to other publications [10, 12].
Methods
Literature searches were performed using the indexed online databases MEDLINE/PubMed using the terms «acquired h(a)emophilia», «acquired factor VIII inhibitors, «acquired inhibitors» and «h(a)emophilia with inhibitors». The full manuscripts from relevant abstracts were retrieved and supplemented by literature from the authors’ own libraries. Approximately 150 articles were retrieved and distributed to the author group. The manuscript was written by the authors, coordinated and supported by Physicians World Europe GmbH, Mannheim, Germany. Recommendations were formulated according to the method of Guyatt et al. [13], where «we recommend» represents a strong (Grade 1) recommendation and «we suggest» a weak (Grade 2) recommendation. Because no high or medium-level evidence exists to support management recommendations, the literature cited was not graded according to level of evidence. A parallel manuscript for specialist physicians was also developed [12].
The authors comprise an independent, international medical collaboration with expertise in the field of AHA. The need for increased awareness of the disorder and practice-based guidelines was initially suggested by one member of the author group (CK). The group’s activities were funded by unrestricted educational grants from Novo Nordisk Health Care AG, Zurich, Switzerland, a company that commercializes recombinant factor VIIa (NovoSeven®), an agent manufactured by Novo Nordisk A/S, Bagsvaerd, Denmark and used to treat bleeding in AHA.
Results and Discussion
Diagnosis
Clinical presentation
Patients with AHA tend to be elderly, with a median age of 77 years [11]. The incidence per million per year increases with age from 0.3 in 16-64 year olds to 9 in 65-84 year olds and 15 in those aged 85 and older [5]. Patients with AHA present with a bleeding pattern that is distinct from congenital hemophilia. Severity in congenital hemophilia can be predicted from the factor VIII level, and patients predominantly experience hemarthroses, trauma-induced muscle bleeds and other soft tissue bleeds. AHA patients typically present with widespread subcutaneous bleeds (seen in 80% of cases) and other soft tissue and mucosal bleeding such as muscle hematoma, urinogenital tract bleeding (including post partum) and other mucosal sites. Compartment syndromes associated with neurovascular injury are also seen, however hemarthroses are uncommon (Tables 1 & 2). Bleeds in AHA are often spontaneous, and the severity does not correlate with the factor VIII level [3] or strength of the inhibitor. Severe bleeding following invasive procedures is almost inevitable, and venipuncture commonly results in extensive subcutaneous bleeding. Fatal hemorrhage occurs in about 9-22% of cases [5, 8]. In contrast, mild bleeding, requiring no haemostatic treatment, is seen in about 30% of cases [1, 5, 8, 14, 15] (Figure 1). Patients occasionally present with abnormal routine blood tests without clinical evidence of bleeding.
Full size table
Full size table
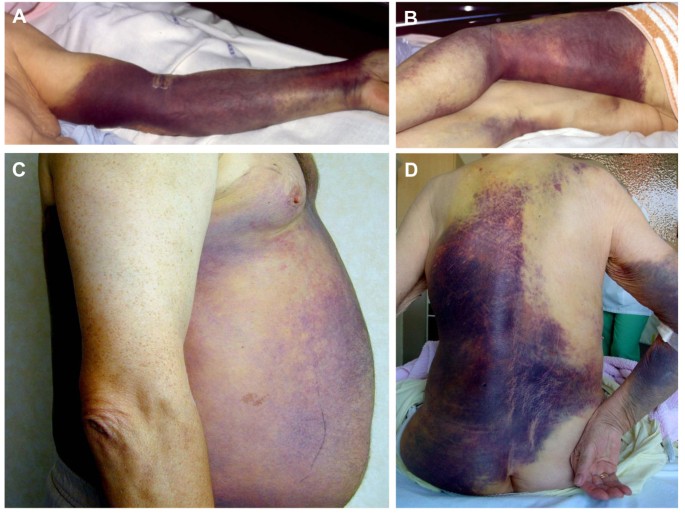
Extensive subcutaneous ecchymoses of the limbs, thorax and abdomen.
Full size image
Patients remain at risk of fatal bleeding until the inhibitor has been eradicated, even if they initially present with mild or no bleeding [5]. Early hemorrhagic deaths, within the first week, may result from gastrointestinal or lung bleeding, whereas later deaths are predominantly due to soft tissue bleeding such as intracranial and retroperitoneal bleedings [5].
In about half of patients, an underlying condition is observed (Table 3). Autoimmune diseases, including rheumatoid arthritis and systemic lupus erythematosus, polymyalgia rheumatica, malignancies, dermatologic disease (especially pemphigoid) and pregnancy are common [5, 8, 14]. Associated medical conditions and treatment may contribute to the clinical presentation and response to treatment.
Full size table
We recommend that physicians managing a patient with suspected or confirmed acquired hemophilia A, with or without bleeding, consult a hemophilia centre with expertise in managing inhibitors as soon as possible.
AHA requires specialist clinical and laboratory expertise and facilities for diagnosis and treatment [9, 10]. Transfer to a specialist centre is often appropriate. If consultation with or transfer to a hemophilia centre is not immediately possible then investigation and treatment should be initiated while a liaison is being established.
Laboratory investigation
We recommend that a diagnosis of acquired hemophilia A be considered in all patients with recent onset of bleeding and/or an unexplained prolonged activated partial thromboplastin time with a normal prothrombin time.
We suggest use of an algorithm such as that shown in Figure2for the differential diagnosis of an isolated prolonged activated partial thromboplastin time (aPTT).
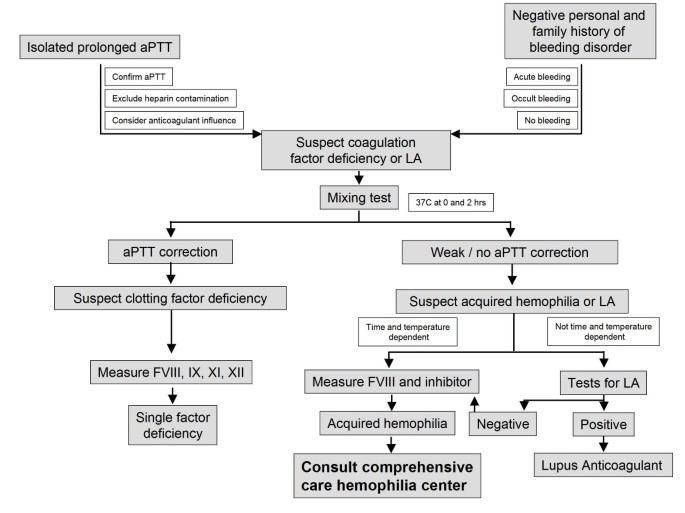
Algorithm to guide the management of patients with suspected acquired hemophilia. AH, acquired hemophilia; LA, lupus anticoagulant; F, coagulation factor; aPTT, activated partial thromboplastin time.
Full size image
The diagnosis of AHA is suggested by the clinical picture and confirmed by laboratory investigation. First-line investigations for a patient with unexplained bleeding include a full blood count to assess platelet number and a coagulation screen. The typical finding in patients with AHA is a prolonged aPTT with a normal prothrombin time (PT).
Investigation of an isolated prolonged activated partial thromboplastin time
A prolonged aPTT with a normal PT may be due to a deficiency of one of the intrinsic coagulation factors (FVIII, IX, XI or XII) or indicate the presence of an inhibitor. An inhibitor may be against one of the intrinsic factors, most commonly FVIII, but may also be a lupus anticoagulant. Tests for a lupus anticoagulant will be normal in the presence of a FVIII inhibitor, but a lupus anticoagulant may lead to artefactually low factor VIII levels and therefore mimic AHA [16].
Irrespective of the presence or absence of bleeding, an isolated prolonged aPTT outside the normal range should be investigated further. If a patient has bleeding suggestive of AHA further investigation is required even if the aPTT is normal. Some prolonged aPTTs are clinically insignificant but must be adequately investigated to exclude an intrinsic factor deficiency or an inhibitor before this conclusion can be drawn.
Mixing tests
To differentiate between an inhibitor and a factor deficiency, mixing studies with normal plasma are used. In these studies patient plasma is mixed with pooled normal plasma in a ratio of 1:1. If the patient plasma has a prolonged aPTT secondary to a deficiency of a clotting factor then the normal plasma will provide the missing factor and the aPTT will be corrected to normal. If on the other hand a patient has an inhibitor to factor VIII, then the factor VIII in the normal plasma will be inhibited and the aPTT will not correct. Failure of normal plasma to correct the aPTT by more than 50% is usually taken as evidence that an inhibitor is present [17], although in some laboratories other definitions are used, and there is no international consensus. FVIII inhibitors, however, are time- and temperature-dependent because the inhibitor does not inhibit the factor VIII in the normal plasma immediately. Therefore, mixing studies must be incubated for 1-2 h at 37°C [10, 18]. A mixing study performed without incubation for 1-2 hours or at a lower temperature may result in correction of the aPTT and the diagnosis of AHA potentially missed. Correction of the aPTT with normal plasma does not exclude a FVIII inhibitor, and if the clinical picture is suggestive of AHA, further investigation is warranted. If mixing tests are compatible with an inhibitor, or the clinical picture is suggestive of AHA, the sample should be urgently referred to a specialist hemostasis laboratory for further investigation by Bethesda assay to measure the strength of the factor VIII inhibitor [19].
Treatment
The principles of treating AHA are to control bleeding, avoid procedures that may induce bleeds, initiate immunosuppression to eradicate the inhibitor and treat any underlying disease [3, 4, 9, 10, 20].
We recommend that invasive diagnostic or therapeutic procedures not be undertaken unless essential and cannot be delayed. Invasive procedures should be undertaken at a hemophilia centre experienced in the treatment of inhibitors.
Patients with AHA should not be subjected to invasive procedures, unless these are essential and cannot be delayed, because uncontrollable bleeding may result from even minor procedures. Venipuncture, the placement of a venous cannula and measurement of blood pressure may also lead to severe bleeding and should be kept to a minimum. Lumbar puncture should not be performed without haemostatic cover. Intramuscular injections are contraindicated. Unavoidable invasive procedures such as the placement of central lines, arterial puncture for blood gas assessment or lumbar puncture should be performed under cover of a bypassing agent.
Treatment of hemorrhage
We recommend that bleeding episodes in patients with AHA be treated in consultation with a hemophilia centre experienced in the treatment of inhibitors.
Many patients require immediate treatment to control bleeding, but not all types of bleeding require intervention [5, 15]. The cardiovascular comorbidities associated with advanced age may put patients at risk of thrombotic complications during haemostatic therapy. Factor VIII levels or inhibitor titers are of no value in guiding anti-hemorrhagic treatment [3, 4, 10].
First-line treatment of bleeding in AHA is with a bypassing agent. The two available licensed treatments are recombinant factor VIIa (rFVIIa, NovoSeven®) [21, 22] and the activated prothrombin complex concentrate (aPCC) (FEIBA®; Factor VIII inhibitor bypassing activity) [23]. The treating physician should be experienced in the use of these products [24, 25], or should transfer the patient to a centre where this expertise is available. If transfer is not possible, then haemostatic treatment should not be delayed and treatment should be initiated at standard doses while contact with a hemophilia centre is established for advice. Standard treatment with rFVIIa is 90 mcg/kg every 2 h until the bleed has been controlled followed by further, less frequent dosing, to prevent recurrence. FEIBA is dosed at 50-100 U/kg every 8-12 h with a maximum dose of 200 U/kg/day until the bleed has been controlled with additional doses to prevent recurrence.
Data on the efficacy of anti-hemorrhagic treatment are retrospective and include a limited number of patients with a wide range of conditions. Prospective randomized clinical studies that compare the efficacy of the available agents in AHA have not been performed and are impracticable due to the rarity and diverse clinical features of the disorder. A prospective randomized trial of hemarthroses in congenital hemophilia did not demonstrate any difference in efficacy between rFVIIa and FEIBA, although criteria for equivalence were not met [26]. This study must be viewed with caution in the context of AHA because, while hemarthroses are common in congenital hemophilia, they are unusual in AHA. Retrospective studies and clinical experience in AHA show that bypassing agents are effective in about 90% of patients [22, 23, 26]. In cases where one bypassing agent is ineffective, good efficacy may be achieved with the alternative agent.
The use of bypassing agents in AHA is associated with a risk of arterial thrombosis because many patients have cardiovascular risk factors. A literature review reported that 7% of patients treated with rFVIIa experienced a thrombotic event [22]. The high risk of life-threatening bleeding if bleeds are not treated early and adequately, however, outweighs the risk of thrombosis in most situations, although large subcutaneous bleeds often require no treatment.
Response to haemostatic therapy is usually best assessed clinically and by measurement of the hemoglobin or hematocrit. Radiological imaging sometimes plays a role. There are no laboratory tests that have been demonstrated to be useful for monitoring the efficacy of bypassing agents. After hemostasis has been achieved, further treatment may be required to prevent re-bleeds at the same site.
If the level of the inhibitor is very low and no bypassing agent is available, hemostasis can sometimes be achieved with high doses of FVIII [27]. The response to this treatment, however, is unpredictable and the use of factor VIII should not delay the use of agents more likely to control bleeding. Factor VIII is more efficacious when used as part of multimodal treatment regimens that include immunoadsorption to temporarily remove the inhibitor. However, at the time of writing immunoadsorption columns are not available in all countries, and this therapy is available in only a few highly specialized centers [27–29].
Desmopressin (DDAVP) at a dose of 0.3 mcg/kg intravenously may be useful in the context of minor bleeding episodes and very low titer inhibitors [30–33] but the use of DDAVP should not delay the use of more effective drugs. There is no evidence to support the use of intravenous gammaglobulin as a single agent to resolve bleeding.
Treatment to eradicate the inhibitor
We recommend that all patients diagnosed with acquired hemophilia A receive immunosuppressive therapy immediately following diagnosis.
The risk of fatal bleeding continues until the factor VIII antibody has been eradicated, therefore immunosuppression should be commenced in all patients as soon as the diagnosis has been made [2]. Immunosuppression is best undertaken in consultation with a hemophilia centre experienced in the management of inhibitors, but if advice is not immediately available, treatment should not be delayed.
The optimal strategy for inhibitor eradication is unknown. The two most common regimens are corticosteroids alone or corticosteroids combined with cyclophosphamide (for reviews see [1, 9]). Some experts recommend the combination of steroids and cyclophosphamide as initial treatment, asserting that the inhibitor is eradicated more rapidly [20]. However, the published evidence from retrospective studies suggests that neither strategy leads to a superior outcome [1, 5, 9] and the only randomized study comparing the two regimens did not recruit sufficient patients to be interpretable [34]. Reviews of published data and large cohorts suggest that about 70-80% of patients achieve remission with steroids alone or steroids combined with cyclosphosphamide but studies have variable treatment regimens and different definitions of endpoints and so cannot be directly compared [1, 5, 9]. We therefore suggest that immunosuppression be initiated with either prednisolone alone at a dose of 1 mg/kg or a combination of prednisolone and cyclophosphamide (1-2 mg/kg).
The median time to remission with corticosteroid treatment is about 5 weeks [9], however if the factor VIII level has not started to increase and the inhibitor titer decline after 2-3 weeks, an alternative immunosuppressive regimen should be considered. If corticosteroid treatment has been initiated and fails to induce remission, commonly used strategies include the addition of cyclophosphamide [1, 9, 10, 34] or rituximab [1, 7, 34], although rituximab is not licensed for this indication. Third-line therapies include rituximab [35–37], if not already used, or combinations of cytotoxic agents or cyclosporin [38, 39]. The side effects associated with these drugs must be taken into consideration, particularly in the context of patient age [11]. Neutropenia with subsequent infections and sepsis have been reported and may contribute to patient mortality [1, 5, 14, 39–43].
Patients may be monitored on an outpatient basis, except in the presence of bleeding or high comorbidity. Patients should be educated about how to report relevant symptoms and access specialist services on a 24-hour basis. Routine monitoring should include physical examination, hemogram, aPTT, FVIII activity and FVIII inhibitor titer assessments. Relapse is seen in up to 20% of patients, and prolonged follow-up is required [5]. Elevated FVIII levels in AHA patients in remission are common, and appropriate prophylactic management in thrombosis-prone patients should be considered during high risk clinical episodes [44]. Thromboembolic risk in general should be managed as in any other patient without a history of a coagulation disorder [45], although there are no studies into thromboprophylaxis in the context of patients recovering from AHA.
Conclusions
Because AHA is a rare but often fatal disorder that usually presents to clinicians without previous experience of the disorder there is often a delay in diagnosis and hence under treatment. Due to the high mortality and morbidity associated with this condition and the complexity of diagnosis and treatment, immediate consultation with a hemophilia centre experienced in the management of inhibitors should be initiated whenever AHA, with or without bleeding, is suspected.
The aim of these recommendations is to increase the awareness of this disorder among health care professionals to whom AHA hemophilia patients are likely to present, encourage timely referral to an experienced specialist physician and create a standardized level of care for this patient group.
Abbreviations
- AHA:
-
acquired hemophilia A
- aPCC:
-
activated prothrombin complex concentrate
- aPTT:
-
activated partial thromboplastin time
- DDAVP:
-
desmopressin
- F:
-
coagulation factor
- FEIBA:
-
factor VIII inhibitor bypassing activity
- PT:
-
prothrombin time
- rF:
-
recombinant factor.
References
-
Delgado J, Jimenez-Yuste V, Hernandez-Navarro F, Villar A: Acquired haemophilia: review and meta-analysis focused on therapy and prognostic factors. Br J Haematol. 2003, 121 (1): 21-35. 10.1046/j.1365-2141.2003.04162.x.
Article
CAS
PubMedGoogle Scholar
-
Hay CR: Acquired haemophilia. Baillieres Clin Haematol. 1998, 11 (2): 287-303. 10.1016/S0950-3536(98)80049-8.
Article
CAS
PubMedGoogle Scholar
-
Kessler CM, Asatiani E: Acquired Inhibitors to Factor VIII. Textbook of Hemophilia. Edited by: Lee CA, Berntorp EE, Hoots WK, Aledort LM. 2007, 86-90.
Google Scholar
-
Morrison AE, Ludlam CA: Acquired haemophilia and its management. Br J Haematol. 1995, 89 (2): 231-236. 10.1111/j.1365-2141.1995.tb03294.x.
Article
CAS
PubMedGoogle Scholar
-
Collins PW, Hirsch S, Baglin TP, Dolan G, Hanley J, Makris M, Keeling DM, Liesner R, Brown SA, Hay CR: Acquired hemophilia A in the United Kingdom: a 2-year national surveillance study by the United Kingdom Haemophilia Centre Doctors’ Organisation. Blood. 2007, 109 (5): 1870-1877. 10.1182/blood-2006-06-029850.
Article
CAS
PubMedGoogle Scholar
-
Collins P, Macartney N, Davies R, Lees S, Giddings J, Majer R: A population based, unselected, consecutive cohort of patients with acquired haemophilia A. Br J Haematol. 2004, 124 (1): 86-90. 10.1046/j.1365-2141.2003.04731.x.
Article
PubMedGoogle Scholar
-
Borg JY, Levesque H, for the SACHA study group: Epidemiology and one-year outcomes in patients with acquired hemophilia in France. J Thromb Haemost. 2007, 5 (suppl 1): O-M-062
Google Scholar
-
Green D, Lechner K: A survey of 215 non-hemophilic patients with inhibitors to Factor VIII. Thromb Haemost. 1981, 45 (3): 200-203.
CAS
PubMedGoogle Scholar
-
Collins PW: Treatment of acquired hemophilia A. J Thromb Haemost. 2007, 5 (5): 893-900. 10.1111/j.1538-7836.2007.02433.x.
Article
CAS
PubMedGoogle Scholar
-
Hay CR, Brown S, Collins PW, Keeling DM, Liesner R: The diagnosis and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors Organisation. Br J Haematol. 2006, 133 (6): 591-605. 10.1111/j.1365-2141.2006.06087.x.
Article
CAS
PubMedGoogle Scholar
-
Baudo F, de Cataldo F: Acquired haemophilia in the elderly. Blood Disorders in the Elderly. Edited by: Balducci L, Ershler W, de Gaetano G. 2007, Cambridge: Cambridge University Press, 389-407.
Google Scholar
-
Huth-Kuhne A, Baudo F, Collins P, Ingerslev J, Kessler CM, Levesque H, Castellano ME, Shima M, St-Louis J: International recommendations on the diagnosis and treatment of patients with acquired hemophilia A. Haematologica. 2009, 94 (4): 566-575. 10.3324/haematol.2008.001743.
Article
PubMed Central
PubMedGoogle Scholar
-
Guyatt G, Gutterman D, Baumann MH, Addrizzo-Harris D, Hylek EM, Phillips B, Raskob G, Lewis SZ, Schunemann H: Grading strength of recommendations and quality of evidence in clinical guidelines: Report from an American College of Chest Physicians task force. Chest. 2006, 129 (1): 174-181. 10.1378/chest.129.1.174.
Article
PubMedGoogle Scholar
-
Morrison AE, Ludlam CA, Kessler C: Use of porcine factor VIII in the treatment of patients with acquired hemophilia. Blood. 1993, 81 (6): 1513-1520.
CAS
PubMedGoogle Scholar
-
Lottenberg R, Kentro TB, Kitchens CS: Acquired hemophilia. A natural history study of 16 patients with factor VIII inhibitors receiving little or no therapy. Arch Intern Med. 1987, 147 (6): 1077-1081. 10.1001/archinte.147.6.1077.
Article
CAS
PubMedGoogle Scholar
-
Greaves M, Cohen H, MacHin SJ, Mackie I: Guidelines on the investigation and management of the antiphospholipid syndrome. Br J Haematol. 2000, 109 (4): 704-715. 10.1046/j.1365-2141.2000.02069.x.
Article
CAS
PubMedGoogle Scholar
-
Kasper CK: Laboratory tests for factor VIII inhibitors, their variation, significance and interpretation. Blood Coagul Fibrinolysis. 1991, 2 (suppl 1): 7-10.
Google Scholar
-
Lossing TS, Kasper CK, Feinstein DI: Detection of factor VIII inhibitors with the partial thromboplastin time. Blood. 1977, 49 (5): 793-797.
CAS
PubMedGoogle Scholar
-
Giles AR, Verbruggen B, Rivard GE, Teitel J, Walker I: A detailed comparison of the performance of the standard versus the Nijmegen modification of the Bethesda assay in detecting factor VIII:C inhibitors in the haemophilia A population of Canada. Association of Hemophilia Centre Directors of Canada. Factor VIII/IX Subcommittee of Scientific and Standardization Committee of International Society on Thrombosis and Haemostasis. Thromb Haemost. 1998, 79 (4): 872-875.
CAS
PubMedGoogle Scholar
-
Franchini M, Lippi G: Acquired factor VIII inhibitors. Blood. 2008, 112 (2): 250-255. 10.1182/blood-2008-03-143586.
Article
CAS
PubMedGoogle Scholar
-
Hay CR, Negrier C, Ludlam CA: The treatment of bleeding in acquired haemophilia with recombinant factor VIIa: a multicentre study. Thromb Haemost. 1997, 78 (6): 1463-1467.
CAS
PubMedGoogle Scholar
-
Sumner MJ, Geldziler BD, Pedersen M, Seremetis S: Treatment of acquired haemophilia with recombinant activated FVII: a critical appraisal. Haemophilia. 2007, 13 (5): 451-461. 10.1111/j.1365-2516.2007.01474.x.
Article
CAS
PubMedGoogle Scholar
-
Sallah S: Treatment of acquired haemophilia with factor eight inhibitor bypassing activity. Haemophilia. 2004, 10 (2): 169-173. 10.1046/j.1365-2516.2003.00856.x.
Article
CAS
PubMedGoogle Scholar
-
Novo Nordisk Health Care AG: NovoSeven Summary of Product Characteristics. 2006
Google Scholar
-
Baxter Corp: FEIBA VH Anti-inhibitor coagulant complex Vapor Heated. Summary of Product Characteristics. 2005
Google Scholar
-
Astermark J, Donfield SM, DiMichele DM, Gringeri A, Gilbert SA, Waters J, Berntorp E: A randomized comparison of bypassing agents in hemophilia complicated by an inhibitor: the FEIBA NovoSeven Comparative (FENOC) Study. Blood. 2007, 109 (2): 546-551. 10.1182/blood-2006-04-017988.
Article
CAS
PubMedGoogle Scholar
-
Kasper CK: Human factor VIII for bleeding in patients with inhibitors. Vox Sang. 1999, 77 (Suppl 1): 47-48. 10.1159/000056716.
Article
CAS
PubMedGoogle Scholar
-
Zeitler H, Ulrich-Merzenich G, Hess L, Konsek E, Unkrig C, Walger P, Vetter H, Brackmann HH: Treatment of acquired hemophilia by the Bonn-Malmo Protocol: documentation of an in vivo immunomodulating concept. Blood. 2005, 105 (6): 2287-2293. 10.1182/blood-2004-05-1811.
Article
CAS
PubMedGoogle Scholar
-
Freedman J, Rand ML, Russell O, Davis C, Cheatley PL, Blanchette V, Garvey MB: Immunoadsorption may provide a cost-effective approach to management of patients with inhibitors to FVIII. Transfusion. 2003, 43 (11): 1508-1513. 10.1046/j.1537-2995.2003.00559.x.
Article
CAS
PubMedGoogle Scholar
-
Muhm M, Grois N, Kier P, Stumpflen A, Kyrle P, Pabinger I, Bettelheim P, Hinterberger W, Lechner K: 1-Deamino-8-D-arginine vasopressin in the treatment of non-haemophilic patients with acquired factor VIII inhibitor. Haemostasis. 1990, 20 (1): 15-20.
CAS
PubMedGoogle Scholar
-
de la Fuente B, Panek S, Hoyer LW: The effect of 1-deamino 8 D-arginine vasopressin (DDAVP) in a nonhaemophilic patient with an acquired type II factor VIII inhibitor. Br J Haematol. 1985, 59 (1): 127-131. 10.1111/j.1365-2141.1985.tb02972.x.
Article
CAS
PubMedGoogle Scholar
-
Naorose-Abidi SM, Bond LR, Chitolie A, Bevan DH: Desmopressin therapy in patients with acquired factor VIII inhibitors. Lancet. 1988, 1 (8581): 366-10.1016/S0140-6736(88)91169-5.
Article
CAS
PubMedGoogle Scholar
-
Mudad R, Kane WH: DDAVP in acquired hemophilia A: case report and review of the literature. Am J Hematol. 1993, 43 (4): 295-299. 10.1002/ajh.2830430413.
Article
CAS
PubMedGoogle Scholar
-
Green D, Rademaker AW, Briet E: A prospective, randomized trial of prednisone and cyclophosphamide in the treatment of patients with factor VIII autoantibodies. Thromb Haemost. 1993, 70 (5): 753-757.
CAS
PubMedGoogle Scholar
-
Wiestner A, Cho HJ, Asch AS, Michelis MA, Zeller JA, Peerschke EI, Weksler BB, Schechter GP: Rituximab in the treatment of acquired factor VIII inhibitors. Blood. 2002, 100 (9): 3426-3428. 10.1182/blood-2002-03-0765.
Article
CAS
PubMedGoogle Scholar
-
Stasi R, Brunetti M, Stipa E, Amadori S: Selective B-cell depletion with rituximab for the treatment of patients with acquired hemophilia. Blood. 2004, 103 (12): 4424-4428. 10.1182/blood-2003-11-4075.
Article
CAS
PubMedGoogle Scholar
-
Franchini M: Rituximab in the treatment of adult acquired hemophilia A: a systematic review. Crit Rev Oncol Hematol. 2007, 63 (1): 47-52. 10.1016/j.critrevonc.2006.11.004.
Article
PubMedGoogle Scholar
-
Sohngen D, Specker C, Bach D, Kuntz BM, Burk M, Aul C, Kobbe G, Heyll A, Hollmig KA, Schneider W: Acquired factor VIII inhibitors in nonhemophilic patients. Ann Hematol. 1997, 74 (2): 89-93. 10.1007/s002770050263.
Article
CAS
PubMedGoogle Scholar
-
Lian EC, Larcada AF, Chiu AY: Combination immunosuppressive therapy after factor VIII infusion for acquired factor VIII inhibitor. Ann Intern Med. 1989, 110 (10): 774-778.
Article
CAS
PubMedGoogle Scholar
-
Shaffer LG, Phillips MD: Successful treatment of acquired hemophilia with oral immunosuppressive therapy. Ann Intern Med. 1997, 127 (3): 206-209.
Article
CAS
PubMedGoogle Scholar
-
Lian EC, Villar MJ, Noy LI, Ruiz-Dayao Z: Acquired factor VIII inhibitor treated with cyclophosphamide, vincristine, and prednisone. Am J Hematol. 2002, 69 (4): 294-295. 10.1002/ajh.10070.
Article
CAS
PubMedGoogle Scholar
-
Bossi P, Cabane J, Ninet J, Dhote R, Hanslik T, Chosidow O, Jouan-Flahault C, Horellou MH, Leynadier F, Liozon E: Acquired hemophilia due to factor VIII inhibitors in 34 patients. Am J Med. 1998, 105 (5): 400-408. 10.1016/S0002-9343(98)00289-7.
Article
CAS
PubMedGoogle Scholar
-
Huang YW, Saidi P, Philipp C: Acquired factor VIII inhibitors in non-haemophilic patients: clinical experience of 15 cases. Haemophilia. 2004, 10 (6): 713-721. 10.1111/j.1365-2516.2004.01031.x.
Article
PubMedGoogle Scholar
-
Onitilo AA, Skorupa A, Lal A, Ronish E, Mercier RJ, Islam R, Lazarchick J: Rituximab in the treatment of acquired factor VIII inhibitors. Thromb Haemost. 2006, 96 (1): 84-87.
CAS
PubMedGoogle Scholar
-
Geerts WH, Pineo GF, Heit JA, Bergqvist D, Lassen MR, Colwell CW, Ray JG: Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004, 126 (3 Suppl): 338S-400S. 10.1378/chest.126.3_suppl.338S.
Article
CAS
PubMedGoogle Scholar
Download references
Acknowledgements
Support for literature searches, meeting organization and medical writing were provided by Physicians World Europe GmbH, Mannheim, Germany. Costs incurred for travel, hotel accommodation, meeting facilities, remote communication and manuscript preparation were supported by unrestricted educational grants from Novo Nordisk Health Care AG, Zurich, Switzerland.
Author information
Authors and Affiliations
-
Arthur Bloom Hemophilia Centre, School of Medicine, Cardiff University, University Hospital of Wales, Cardiff, CF14 4XN, UK
Peter Collins
-
Thrombosis and Hemostasis Unit, Niguarda Hospital, I-20162, Milan, Italy
Francesco Baudo
-
SRH Kurpfalzkrankenhaus Heidelberg GmbH and Hemophilia Centre, D-69123, Heidelberg, Germany
Angela Huth-Kühne
-
Centre for Hemophilia and Thrombosis, Skejby University Hospital, Department of Clinical Biochemistry, DK-8200, Aarhus, Denmark
Jørgen Ingerslev
-
Department of Medicine and Pathology, Division of Hematology/Oncology and Georgetown University Hospital, Lombardi Cancer Center, Division of Hem/Onc, Washington, DC, 20057, USA
Craig M Kessler
-
Regional Universitary Hospital Carlos Haya, Division of Hematology, E-29004, Málaga, Spain
Maria E Mingot Castellano
-
Department of Pediatrics, Nara Medical University, 634-8522, Nara, Japan
Midori Shima
-
Department of Medicine, Université de Montréal and Hématologie-Oncologie, Hôpital Maisonneuve-Rosemont, Montréal, QC, H1T 2 M4, Canada
Jean St-Louis
-
Department of Internal Medicine, Centre Hospitalier Universitaire de Rouen-Boisguillaume, F- 76031, Rouen, France
Hervé Lévesque
Authors
- Peter Collins
You can also search for this author in
PubMed Google Scholar - Francesco Baudo
You can also search for this author in
PubMed Google Scholar - Angela Huth-Kühne
You can also search for this author in
PubMed Google Scholar - Jørgen Ingerslev
You can also search for this author in
PubMed Google Scholar - Craig M Kessler
You can also search for this author in
PubMed Google Scholar - Maria E Mingot Castellano
You can also search for this author in
PubMed Google Scholar - Midori Shima
You can also search for this author in
PubMed Google Scholar - Jean St-Louis
You can also search for this author in
PubMed Google Scholar - Hervé Lévesque
You can also search for this author in
PubMed Google Scholar
Corresponding author
Correspondence to
Peter Collins.
Additional information
Competing interests
PC has received honoraria for consulting or lecturing from Baxter, Novo Nordisk, Bayer and Ipsen, educational grants from Baxter and Bayer and institutional support from Baxter; FB has received honoraria for consulting or lecturing from Bayer HealthCare, and Novo Nordisk; AH-K has received honoraria for consulting or lecturing from Bayer HealthCare, Novo Nordisk and Wyeth; JI has received honoraria for consulting or lecturing from Baxter, Novo Nordisk, Bayer, Wyeth, educational grants from BioVitrum and institutional support from STER, Baxter and BioVitrum; CMK‘s institution receives research funding for clinical trials on his behalf from Baxter Immuno, Novo Nordisk, Octapharma, Grifols, Genentech and Bayer. He has received honoraria for consulting or lecturing from Wyeth, Octapharma, Bayer, Baxter Immuno, Ipsen and Novo Nordisk; MEMC has received honoraria for consulting or lecturing for Novo Nordisk, Grifols, Baxter and Wyeth. No other relevant financial associations are reported by the Thrombosis and Haemostasis section of the Haematology department at the Regional University Hospital of Carlos Haya, Malaga (Spain); MS reported no relevant financial associations; JSL has received honoraria for consulting from Baxter and Novo Nordisk, educational grants from Bayer and research grants from Ipsen and Novartis; HL has received honoraria for consulting or lecturing from Novo Nordisk.
Authors’ contributions
FB, AH-K, HL, MEMC and JSL were present at one or both of two initial meetings to define the scope of the present manuscript and the published guidelines for specialist physicians. FB, JI, AH-K, HL, MEMC, MS and JSL were present during the first consensus meeting to present the results of the literature review process.
Three working groups were formed to write each section of both manuscripts; communication occurred electronically or by telephone: diagnosis (PC, JI, MS), hemorrhagic treatment (FB, CMK, JSL), inhibitor eradication (HL, AH-K, MEMC).
FB, JI, CMK, JSL, AH-K, HL and MEMC were present for the final consensus meeting on both guideline manuscripts. PC prepared the final draft of the manuscript, which was reviewed and approved by all authors. The opinions expressed in this manuscript are those of the authors alone. All authors had full access to all of the literature described here and take responsibility for the integrity of the data and the accuracy of the data analysis.
Authors’ original submitted files for images
Rights and permissions
This article is published under license to BioMed Central Ltd. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Reprints and Permissions
About this article
Cite this article
Collins, P., Baudo, F., Huth-Kühne, A. et al. Consensus recommendations for the diagnosis and treatment of acquired hemophilia A.
BMC Res Notes 3, 161 (2010). https://doi.org/10.1186/1756-0500-3-161
Download citation
-
Received: 12 March 2010
-
Accepted: 07 June 2010
-
Published: 07 June 2010
-
DOI: https://doi.org/10.1186/1756-0500-3-161
Keywords
- Factor Viii
- Prothrombin Complex Concentrate
- DDAVP
- Recombinant Factor VIIa
- Polymyalgia Rheumatica
4.1 Определения
Гемофилия — геморрагическое заболевание, возникающее вследствие
генетически обусловленного снижения активности фактора VIII (гемофилия А) или фактора IX (гемофилия В) свертывания крови.
Болезнь Виллебранда — геморрагическое заболевание, возникающее вследствие количественного или (и) качественного дефекта фактора Виллебранда.
4.2 Основная информация
Гемофилия — генетически обусловленное геморрагическое заболевание, возникающее вследствие дефицита факторов VIII или (и) IX свертывания крови, при нормальной активности фактора Виллебранда. Подавляющее большинство больных гемофилией — мужчины, в редких случаях возможно заболевание у женщин. У женщин — носителей мутации гена фактора VIII (ф.УШ) или фактора IX (ф.ГХ) могут быть геморрагические проявления. В этом случае они должны рассматриваться, как больные гемофилией.
Распространенность гемофилии в большинстве стран составляет 10-14 больных на 100000 мужчин. При этом соотношение гемофилии А (ГА) и гемофилии В (ГВ) составляет в среднем 4:1.
Имеются единичные описания сочетанного первичного снижения активности факторов VIII и IX свёртывания крови. Такое состояние обозначается как сочетанная гемофилия.
Основное проявление гемофилии — кровотечения и кровоизлияния, возникающие вследствие травм. Кровотечения развиваются сразу после травмы, но часто происходит первичная остановка с последующим рецидивом кровотечения спустя некоторое время. Кроме того, кровотечения при гемофилии могут возникать
после небольшой травмы, не соответствующей по тяжести выраженности геморрагического проявления. Эти обстоятельства приводят к потере связи кровоизлияния и травмы, в этом случае говорят о «спонтанных»
кровоизлияниях и кровотечениях.
Основные компоненты патологического процесса при гемофилии:
-
кровоизлияния, повреждающие органы и ткани
-
кровотечения, приводящие к физиологически значимой кровопотере
-
рецидивирующие кровоизлияния в суставы, приводящие кформированию хронического
воспалительного процесса, разрушению суставных поверхностей и нарушению функции суставов
При отсутствии адекватной помощи пациенты с тяжёлой и среднетяжёлой формой гемофилии могут погибнуть от кровопотери, кровоизлияния в жизненно важные органы. Эти дети страдают от выраженного болевого синдрома, возникающего в связи с кровоизлияниями. К 5 — 7 годам может развиться значимое нарушение функции суставов, гипотрофия мышц. Дети теряют подвижность, возможность обслуживать себя.
Все эти факторы приводят к значительной физической психологической и социальной дезадаптации, 10 — 14 годам дети становятся тяжёлыми инвалидами.
Основная лечебная стратегия — проведение заместительной терапии препаратами, содержащими недостающие факторы свёртывания крови.
Современные подходы к ведению детей с гемофилией позволяют сохранить здоровье и избежать значимого поражения суставов более, чем у 95% детей с тяжёлой и среднетяжёлой гемофилией и у 100% детей с лёгкой формой заболевания.
Наиболее значимым осложнением гемофилии, возникающим в ответ на лечение, является выработка блокирующих антител (ингибитора) к факторам свёртывания VIII или IX — развитие ингибиторной (осложнённой) гемофилии. Частота развития ингибитора колеблется в широких пределах и, в среднем, составляет 10 — 15%. Наиболее велик шанс развития ингибитора в течение первых 20 дней введения препаратов факторов свёртывания крови VIII и IX. В дальнейшем, риск значительно снижается, но остаётся на протяжении всей жизни больного.
Физиология фактора Виллебранда, этиология и патогенез заболевания
ФВ выполняет 2 основные функции в гемостазе:
-
является молекулой адгезии, обеспечивающей надежную фиксацию тромбоцитов к коллагену
субэндотелия и друг к другу -
связывает ф VIII и защищает его от преждевременной протеолитической инактивации
ФВ синтезируется в эндотелиоцитах и мегакариоцитах. Синтезированный фВ поступает в кровь и субэндотелиальный матрикс. Кроме этого фВ депонируется в альфа-гранулах тромбоцитов и тельцах Вейбла-Палада эндотелиоцитов.
Зрелый фВ представлен рядом полимеров прогрессивно увеличивающейся молекулярной массы: от 540 kDa у димеров до нескольких тысяч kDa у самых крупных мультимеров. Активность фВ зависит от его молекулярной массы. Наибольшей активностью обладают самые крупные мультимеры фВ.
Наиболее высокомолекулярный фВ находится в тельцах Вейбла-Палада эндотелиоцитов. После поступления в плазму происходит постепенная редукция его молекулярной массы под воздействием металлопротеазы ADAMTS 13.
Можно выделить 3 основных типа активности фВ:
-
активность связывания с тромбоцитарными рецепторами (ристомицин кофакторная активность)
-
активность связывания с коллагеном (коллаген связывающая активность)
-
активность связывания с фVIII (фактор VIII связывающая активность)
При большинстве форм бВ нарушается адгезия тромбоцитов (ристомицин кофакторная активность и коллаген-связывающая активность), что приводит к удлинению процесса остановки кровотечений. Кроме этого, при бВ может снижаться фактор VIII связывающая активность, при этом укорачивается период полувыведения ф VIII, снижается его активность в крови и происходит нарушение процесса свёртывания
крови.
4.3 Классификация гемофилий и болезни Виллебранда
Классификация гемофилии по типам:
-
снижение активности ф.VIII — гемофилия А;
-
снижение активности ф.IX — гемофилия В;
-
сочетанное снижение активности ф.VIII и ф.IX — сочетанная гемофилия.
Классификация гемофилии по тяжести (одинаковая для гемофилии А и В).
Классификация основана на определении активности VIII или IX факторов свертывания крови в плазме пациента:
-
тяжелая форма: активность факторов VIII или IX менее 1%;
-
среднетяжелая форма — с активностью фактора VIII или IX 1 — 5%;
-
легкая — более 5 и менее 50%.
Классификация гемофилии в зависимости от наличия и активности ингибитора:
-
неосложнённая гемофилия (нет лабораторных признаков ингибитора или ингибитор менее 0,6
единиц Бетезда (БЕ)) -
ингибиторная гемофилия:
-
низко реагирующий — активность ингибитора никогда не превышала 5 БЕ,
-
высоко реагирующий — активность ингибитора хотя бы раз была выше 5 БЕ.
-
Классификация болезни Виллебранда по типам:
-
Тип 1: количественное снижение фВ. При этом пропорционально снижаются тяжелые, средние и
легкие мультимеры. Соотношение активности фВ к антигену > 0,6. Активность ф VIII нормальная
или снижена. -
Тип 2: качественные дефекты фВ. Подразделяется на:
-
Тип 2А: преимущественное снижение тяжелых мультимеров фВ. Соотношение активности фВ к антигену < 0,6. Активность ф VIII нормальная или снижена.
-
Тип 2В: избыточный потенциал связывания фВ с рецепторами на тромбоцитах приводит к элиминации тяжелых мультимеров фВ и умеренной тромбоцитопении. Соотношение активности фВ к антигену < 0,6. Активность ф VIII нормальная или снижена.
-
Тип 2М: снижение активности связывания фВ с рецепторами тромбоцитов не сопровождается снижением белка, идентифицируемого, как фВ. Антиген фВ — нормальный. Соотношение активности фВ к антигену < 0,6. Активность ф VIII — нормальная.
-
Тип 2N: изолированное снижение фактор VIII связывающей активности фВ. Ристомицин
кофакторная активность и коллаген связывающая активность не страдает. Снижается активность
ф VIII без нарушения адгезии тромбоцитов.
-
-
Тип 3: полное отсутствие в крови белка, идентифицируемого, как фВ. Активность и антиген фВ —
не определяются (ниже чувствительности метода). Активность ф VIII резко снижена. -
Выделяют еще 2 типа бВ, отнести которые к конкретному типу сложно:
-
Тип Виченза: в крови персистируют сверхвысокомолекулярные мультимеры фВ. Происходит
преждевременная элиминация фВ. Снижается содержание всех мультимеров. -
Изолированное снижение коллаген-связывающей активности фВ.
-
4.4 Клиническая картина
Проявления ГА и ГВ идентичны.
Тяжёлая форма. Для больных тяжелой формой гемофилии характерно появление геморрагического синдрома
на первом году жизни. Относительно редко тенденция к кровотечениям может стать очевидной уже в
неонатальном периоде (кефалогематомы, гематомы мягких тканей, возникающие после инъекций или
вследствие тяжелых родов, кровотечение из пупочного канатика, послеоперационные кровотечения). Как
правило, кожный гемосиндром и гематомы мягких тканей возникают впервые в возрасте до 6 месяцев.
Позднее появляются кровоизлияния других локализаций: межмышечные гематомы, тяжелые посттравматические кровотечения из слизистых полости рта и кровоизлияния в суставы. Поражаются в основном крупные суставы: коленные, голеностопные и локтевые. Кроме этого, у детей с тяжелой гемофилией бывают кровоизлияния в подвздошно¬поясничную мышцу, гематурия, желудочно-кишечные кровотечения (особенно при наличии эрозий, язв, полипов, воспалительного процесса) и кровоизлияния в
центральную нервную систему, кровотечения и кровоизлияния при проведении инвазивных манипуляций. Среднетяжелая форма гемофилии имеет сходные проявления. Первые признаки, как правило развиваются после года. Для детей с активностью факторов более 2% мало характерны кровоизлияния в суставы, забрюшинные гематомы, гематурия. Наиболее характерны посттравматические гематомы и длительные
кровотечения, особенно при травмах слизистых оболочек.
Легкая гемофилия может никак не проявляться на протяжении всей жизни человека. Патологические кровотечения и кровоизлияния у пациентов с легкой формой гемофилии возникают вследствие значительных травм или операций. Поражение опорно-двигательного аппарата у детей с легкой гемофилией встречается
чрезвычайно редко.
Проявления бВ зависят от типа. Наиболее тяжелые проявления развиваются у пациентов с 3 типом. Начало проявлений — в первые дни и недели жизни. Характерны длительные кровотечения из ран, особенно слизистых оболочек, выраженный кожный гемосиндром в виде экхимозов и гематом, позднее развиваются гематомы мягких тканей, рецидивирующие носовые кровотечения. У детей, начавших ходить возможно
развитие гемартрозов с формированием хронического синовиита и артропатии.
У пациентов с тяжелым 1 типом проявления несколько легче. Проявления начинаются до 2 — 3 лет. Характерны длительные кровотечения из ран и со слизистых. Гемартрозы и гематомы также могут развиваться.
Для пациентов с не тяжелым 1 типом, 2А, 2В, 2М типами бВ, в первую очередь характерны длительные кровотечения из ран и со слизистых оболочек. Гематомы мягких тканей и гемартрозы не характерны. Сроки начала проявлений зависят от травмирующих событий в анамнезе пациента. Возможна первичная
диагностика у взрослых или в связи с наличием бВ в семейном анамнезе.
Тип 2 N бВ проявляется так же как нетяжелая гемофилия.
4.5 Диагностика гемофилии и болезни Виллебранда
Обследованию подлежат дети, имеющие признаки геморрагического состояния. Однако, случайно найденные и неоднократно подтвержденные лабораторные данные, не сопровождающиеся клиническими проявлениями также являются основанием для установления диагноза.
Имеющиеся клинические данные, противоречащие системному геморрагическому заболеванию позволяют усомниться в диагнозе гемофилии или болезни Виллебранда и требуют неоднократного лабораторного обследования. В этом случае диагноз устанавливается только при стабильных типичных изменениях. К данным, противоречащим системному геморрагическому заболеванию относится отсутствие избыточной кровоточивости при: хирургических вмешательствах на органах головы и шеи, в том числе при удалении коренных зубов, адено- и тонзиллотомии, хирургических вмешательствах или травмах паренхиматозных органов, губчатых костей, хирургических вмешательствах, связанных с рассечением большого объема
мышечной массы, при скальпированных ранах.
Лабораторная диагностика:
Для диагностики и контроля гемофилии необходимы следующие тесты:
-
АЧТВ, ПВ, ТВ, фибриноген.
-
Активность ф. VIII и ф. IX.
-
Активность ф.Виллебранда
Для диагностики и контроля болезни Виллебранда необходимы следующие тесты:
-
АЧТВ, ПВ, ТВ, фибриноген.
-
Активность ф. VIII и ф. IX.
-
Ристомицин кофакторная активность, коллаген связывающая активность.
-
Антиген ф. Виллебранда.
-
Агрегация тромбоцитов с ристомицином или его аналогами.
-
Агрегация тромбоцитов с АДФ, коллагеном, адреналином.
Для типирования редких форм бВ могут потребоваться: определение фактор VIII связывающей активности фВ или анализ мультимеров фВ.
Диагноз гемофилии устанавливается на основании следующих лабораторных данных:
-
активность ф VIII или ф. IX менее 50%;
-
отсутствие данных о приобретённом геморрагическом состоянии вследствие появления ингибитора к ф.VIII или ф.IX.
-
Нормальная активность фВ
Диагноз БВ устанавливается на основании следующих лабораторных данных:
-
снижение специфической активности фВ: ристомицин кофакторной активности или (и) коллаген-связывающей активности или фактор VIII связывающей активности (при подозрении на тип 2N),
-
для типа 2В: тромбоцитопения, положительный результат теста агрегации с низкими
концентрациями ристомицина или аналогов; (у здоровых лиц агрегация с низкими концентрациями этих реактивов низкая или отсутствует), -
для всех форм — отсутствие данных о приобретённом геморрагическом состоянии
-
для типирования формы БВ необходимо одномоментно с активностью определять концентрацию антигена фВ
При диагностике бВ необходимо помнить, что фВ реагирует повышением на множество воздействий, включая стресс, физические нагрузки, воспаление, уровень эстрогенов и др. Все эти события могут приводить к значительному повышению уровня активности фВ у больных бВ и маскировать заболевание при лабораторном анализе. Поэтому, при подозрении на бВ необходимо проводить неоднократные исследования с учетом всех перечисленных факторов. У менструирующих девушек исследование активности фВ
оптимально выполнять в первые 2 дня менструации. Применение эстроген-содержащих препаратов необходимо исключить не позднее, чем за 6 — 7 дней до планируемого исследования. Во всех случаях необходимо стараться избегать отбора образца после физических нагрузок, стрессов, при длительно
наложенном венозном жгуте, на фоне течения инфекционного или асептического воспаления.
4.6 Терапия
4.6.1 Принципы терапии.
В основе лечения больных неосложненной формой гемофилии лежит специфическая заместительная терапия концентратами факторов свертывания крови VIII при гемофилии А или IX при гемофилии В.
Пациенты с ингибиторной формой гемофилии А и низкореагирующим ингибитором должны получать высокодозную терапию концентратом фактора VIII, а при ее неэффективности — терапию препаратами шунтирующего действия. (Уровень доказательности 4).
Пациенты с ингибиторной формой гемофилии А и высокореагирующим ингибитором, не зависимо от титра
ингибитора на момент лечения должны получать терапию препаратами шунтирующего действия. В порядке исключения возможно краткосрочное применение концентратов фактора VIII в высоких дозах, при кровотечениях, угрожающих жизни и не контролируемых шунтирующими препаратами. (Уровень доказательности 4).
Пациенты с ингибиторной формой гемофилии В должны получать лечение препаратами
шунтирующего действия, не содержащими фактора IX. Применение фактора IX у них может привести к анафилактическим реакциям. (Уровень доказательности 4).
Для лечения больных гемофилией необходимо использовать только очищенные,
вирусинактивированные препараты. Использование неочищенных препаратов
свежезамороженной плазмы или криопреципитата возможно в исключительных случаях и не должно являться постоянной практикой. (Уровень доказательности 4).
Для пациентов с гемофилией, в настоящее время нет оснований для предпочтения той или иной группы концентратов факторов свертывания крови: плазменных, содержащих или не содержащих фактор Виллебранда, рекомбинантных. Однако, в первые эпизоды введения (первые 50 дней введения) необходимо применять только те препараты, которые проходили исследование в группе предварительно не леченных
пациентов и показали низкую иммуногенность. (Уровень доказательности 4).
Поскольку частая смена наименований препаратов факторов VIII и IX приводит к повышению риска развития ингибитора, желательно создать условия для применения пациентом одного наименования в течении длительного времени, даже на протяжении многих лет. При этом предпочтение отдается тому препарату, который лучше всего переносится пациентом, имеет лучшие фармакокинетические показатели и
наиболее удобен в использовании исходя из конкретных условий. (Уровень доказательности 4).
При болезни Виллебранда заместительная терапия проводится препаратами, содержащими фактор Виллебранда: концентрат фVIII с фВ или изолированный концентрат фВ. Показаны препараты, эффективность которых при бВ была доказана в клинических исследованиях. При применении изолированного концентрата фВ для остановки кровотечения у пациентов с 3 типом или тяжелым 1 типом
дополнительно показано введение концентрата фVIII. У пациентов с нетяжелыми формами бВ возможно применение препаратов десмопрессина. Применять последний возможно только после проведения тестов, показывающих его эффективность. Применение десмопрессина у детей до 4 лет противопоказано. В качестве
дополнительного или основного лечения показано применение ингибиторов фибринолиза.
4.6.2 Заместительная терапия
Для гемофилии и бВ при профилактике и остановке кровотечений необходимо придерживаться следующих принципов:
-
заместительная терапия должна проводиться как можно раньше после травмы или появления (объективных или субъективных) признаков кровотечения (кровоизлияния), оптимально — не более
2 часов, -
сразу должна вводиться эффективная доза препарата,
-
при остановке кровотечений из ран необходимо проводить мероприятия для обеспечения
механического ограничения кровотечения (ушивание ран, тампонада и др.) -
профилактическая заместительная терапия предпочтительнее, чем заместительная терапия после развития кровотечения
Основные формы проведения заместительной терапии:
-
Лечение острых кровотечений. Проводится при развитии острого кровотечения у пациентов независимо от тяжести заболевания. Препарат вводится до момент остановки кровотечения.
-
Постоянная профилактика (профилактика развития поражений опорно-двигательного аппарата).
Показаниями для проведения постоянной профилактической заместительной терапии являются:
-
Пациенты с тяжелой формой гемофилии А и В. Показана всем пациентам с тяжелой
гемофилией. Начинается между 1 и 2 годами или после развития первого эпизода
гемартроза. По усмотрению лечащего гематолога возможно более раннее начало.
Проводится постоянно, пожизненно. -
Пациенты с бВ тип 3 или тяжелый тип 1. Показана (начинается) при развитии 1 — 2
эпизодов гемартрозов. По усмотрению лечащего гематолога возможно более раннее
начало. Проводится постоянно, пожизненно. -
Пациентам с активностью фактора более 3% постоянное или длительное
профилактическое лечение необходимо при повторных кровоизлияниях в суставы,
появлении признаков синовиита или артропатии, выраженных геморрагических
проявлениях, требующих частых введений концентратов факторов свертывания.
Первичная профилактика является наиболее эффективной для предотвращения поражения опорно-двигательного аппарата. Сроки могут изменяться в зависимости от состояния венозного доступа, клинического течения гемофилии, практических возможностей организации постоянной заместительной терапии.
Дозы и схемы профилактической терапии
Классическая рекомендованная схема для первичной профилактики при гемофилии А составляет 25- 40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю. Для гемофилии В — 25 — 40 МЕ/кг 1 раз в 3 дня или 2 раза в неделю.
Схемы терапии:
-
Оптимальная схема для гемофилии А: 25 — 40 МЕ/кг х 3 р/нед или 1 раз в 2 дня.
По показаниям возможно использование других схем, при условии их
эффективности. -
Оптимальная схема для гемофилии В: 25 — 40 МЕ/кг х 2 р/нед или 1 раз в 3 дня.
По показаниям возможно использование других схем, при условии их эффективности. -
Оптимальная схема для бВ подбирается индивидуально. При развитии
рецидивирующих гемартрозов, на первом этапе рекомендовано проводить лечение по
схемам, используемым для лечения гемофилии А. -
У детей раннего возраста, имеющих трудности венозного доступа можно начинать с
введения более высоких доз, например, 50 — 70 МЕ/кг 1 — 2 раза в неделю для пациентов с гемофилией А и 1 раз в неделю для пациентов с гемофилией В. В дальнейшем, по мере роста пациента и усиления геморрагического синдрома частота введения должна увеличиваться, а разовая доза снижаться до классических значений. -
При решении о дне и времени введения необходимо учитывать предстоящие значимые физические нагрузки и травмирующие ситуации. Желательно вводить препарат непосредственно перед такими эпизодами. (Уровень доказательности 4).
-
При принятии решения о начале профилактической терапии необходимо учитывать социальные и
психологические аспекты. При наличии объективных трудностей начало первичной профилактики
может быть отложено, причину отказа от профилактического лечения необходимо зафиксировать в
первичной документации, а лечащий гематолог должен принять возможные меры к преодолению
этих обстоятельств. -
Краткосрочная профилактика. Показана всем пациентам с гемофилией А и В, бВ при наличии
дополнительных показаний таких, как травма, предстоящее хирургическое лечение или инвазивная
манипуляция и др. Пациенты, получающие постоянную профилактику могут требовать
краткосрочной, если схема постоянной профилактической терапии недостаточна для обеспечения
надежного гемостаза. Схемы, длительность краткосрочной профилактики подбираются с учетом
характера события. -
Профилактическое лечение пациентам с ингибиторной гемофилией. Пациентам с ингибиторной гемофилией А и В показано профилактическое лечение при условии развития рецидивирующих кровоизлияний в суставы или других выраженных геморрагических проявлений. Для проведения профилактической терапии используются те же препараты шунтирующего действия, что и для остановки кровотечений. Пациентам с ингибиторной формой гемофилии необходим индивидуальный подбор схемы терапии. Необходимо учитывать эффективность используемого препарата у конкретного пациента, состояние венозного доступа, возможности семьи для проведения терапии.
4.6.3 Клинические критерии эффективности постоянной профилактической заместительной терапии
-
Отсутствие кровоизлияний в суставы
-
Отсутствие признаков синовиита
-
Отсутствие частых значимых геморрагических проявлений, требующих
дополнительной специфической заместительной терапии.
Решение о недостаточной эффективности профилактической заместительной терапии принимается в случаях:
-
более 2 эпизодов спонтанных гемартрозов в год
-
появления признаков хронического синовиита или артропатии
-
выраженных спонтанных геморрагических проявлениях другой локализации
4.6.4 Клинические критерии эффективности гемостатической терапии при остановке кровотечений.
-
Остановка кровотечения
-
Уменьшение и прекращение болевого синдрома
-
Остановка нарастания и уменьшение размеров гематомы
4.6.5 Лабораторные тесты для контроля эффективности терапии
Лечение гемофилии (А и В) контролируется тестами:
-
Остаточная активность ф. VIII или IX.
-
Тест восстановления. Показывает на сколько поднимается активность фактора после введения известной дозы из расчета на кг массы тела пациента. Для этого образцы отбирают до введения и через 15 — 30 мин. после введения фактора. результат рассчитывается по формуле:
Восстановление = масса тела х (активность после введения — активность до введения) /доза препарата
Где: масса тела выражается в кг, активность — в % или МЕ в дл, доза в МЕ.
-
Построение фармакокинетической кривой препарата с определением периода полувыведения и клиренса. Проводится путем многократного отбора образцов с определением активности ф. VIII или IX на протяжении 1 — 5 дней. Конкретная схема зависит от задач анализа.
Лечение бВ контролируется аналогичными тестами. В первую очередь определяются показатели специфической активности фВ.
Оценка трех основных параметров одновременно: активности и антигена фВ и активности фVIII показана:
-
у пациентов со сниженной активностью ф. VIII
-
при применении препаратов, содержащих фVIII
-
перед предстоящим хирургическим лечением
-
помимо активности фВ, показано исследование активности фVIII. У пациентов со 2А, 2В, 2М типами, показано определение:
Общепринятых тестов контроля эффективности шунтирующей терапии не разработано.
4.6.6 Недостаточная эффективность заместительной терапии.
Для решения вопроса о причинах недостаточного эффекта профилактической заместительной терапии необходимо:
-
Пересчитать дозу и кратность введения в зависимости от веса пациента.
-
Выполнить анализ с определением активности фактора, определить наличие ингибитора и его титр, провести оценку фармакокинетической кривой с определением теста восстановления, периода полувыведения, оценить активность фактора перед следующим плановым введением, по возможности
построить фармакокинетическую кривую за несколько дней.
Причины недостаточно эффективной заместительной профилактической терапии:
-
развитие ингибитора фактора свертывания крови
-
недостаточная доза и (или) кратность введения
-
несоблюдение режима введения и дозировок пациентом и родителями
-
неадекватная физическая активность пациента
-
индивидуальные особенности пациента, требующие применения более высоких доз или более частого введения препарата
В случае, если ингибитор отсутствует, а теоретические расчеты и полученные фармакокинетические результаты не дают оснований считать дозу и кратность введения недостаточными, необходимо выяснить характер физической активности и соблюдение рекомендованного режима заместительной терапии.
Решение о повышении дозы или кратности должно быть принято если имеются клинические или лабораторные данные о ее недостаточности с учетом имеющихся фармакокинетических данных.
Учитывая, что основная задача профилактической заместительной терапии — сохранение качества жизни
пациента, повышение дозы и (или) кратности более рекомендованных стандартных, допустимо у пациентов с
высоким уровнем физической активности.
4.6.7 Сопутствующая терапия
Десмопрессин
Применение десмопрессина может поднимать активность фактора VIII у пациентов с легкой гемофилией А и бВ. Рекомендовано внутривенное или подкожное введение в разовой дозе 0,3 мкг/кг. Возможно использование специального назального спрея. Разовая доза — 300 мкг. (Уровень доказательности 3).
Применение возможно у детей старше 4 лет.
Препарат вводиться однократно, при повторном введении возможно развитие тахифилаксии. Имеется большая индивидуальная вариабельность ответа на введение десмопрессина. Поэтому, перед его использованием необходимо выполнить тест восстановления, для оценки индивидуальной реакции (анализ активности ф. VIII до и через 1 час после введения терапевтической дозы десмопрессина).
Ингибиторы фибринолиза
Аминокапроновая кислота и транексамовая кислота используется как дополнение к специфической заместительной терапии гемофилии и бВ. Наиболее эффективно при кровотечениях из ран слизистых оболочек и нижележащих отделов желудочно-кишечного тракта. Может использоваться для
лечения кровотечений других локализаций.
Аминокапроновая кислота применяется внутривенно капельно или перорально из расчёта 50 — 100 мг/кг (не более 5 г.) каждые 6 – 8 часов.
Транексамовая кислота применяется с сопоставимой эффективностью внутривенно или перорально из расчёта 25 мг/кг 1 – 3 раза в день.
Допустимо местное применение этих препаратов при кровотечениях со слизистой полости рта.
Применение этих препаратов не требует лабораторного контроля.
ЗАПРЕЩЕНО ИСПОЛЬЗОВАТЬ ПРИ ПОЧЕЧНЫХ КРОВОТЕЧЕНИЯХ.
Местные гемостатические препараты
При проведении оперативных вмешательств, особенно на паренхиматозных органах, при экстракции зубов,
лечении ран показано использование местных гемостатических препаратов: фибринового клея,
гемостатической губки и др. Эти препараты применяются совместно с заместительной терапией и призваны
оптимизировать местный гемостатический эффект.
4.6.8 Комплаентность пациентов и их родителей
Подразумевает набор условий, позволяющих проводить данный вид лечения. Поскольку участие родителей и пациентов в проведении профилактической заместительной терапии очень велико, фактор приверженности лечению и комплаентности семьи может быть решающим для определения основной стратегии ведения пациента. Недостаточная приверженность лечению или некомплаентность семьи пациента не является основанием для отказа в адекватной заместительной терапии. Однако при решении о проведении постоянной
профилактической заместительной терапии возможно отложить, если семья пациента не готова к этому виду
лечения, и отсутствие постоянного профилактического лечения не создает высокого риска жизни и здоровью
пациента.
4.6.9 Венозный доступ
Проведение заместительной профилактической терапии предъявляет высокие требования к состоянию венозного доступа. При необходимости проведения заместительной терапии и отсутствии адекватного венозного доступа показано создание артифициального венозного доступа. У пациентов с гемофилией
возможно применение следующих вариантов:
ЦВК и периферические катетеры краткосрочного применения.
Порты.
Формирование артериовенозных шунтов (мелкие сосуды).
Решение об использовании конкретного варианта артифициального венозного доступа принимается с учетом состояния пациента, ожидаемых осложнений и стоящей задачи.
4.7 Особенности лечения некоторых отдельных проявлений и осложнений гемофилии.
4.7.1 Лечение гемартрозов
Кровоизлияния в суставы проявляются дискомфортом, болью, нарушением функции, флюктуацией.
Гемартроз требует проведения заместительной терапии в рекомендованных дозах.
При развитии выраженного болевого синдрома возможно проведение кратковременной иммобилизации,
которая должна сниматься сразу после прекращения болей.
Пункции сустава с аспирацией содержимого показаны при (уровень доказательности 3):
-
гемартрозе с болевым синдромом, сохраняющимся более суток;
-
признаках развития гнойного артрита;
-
развитии на фоне гемартроза нервно-мышечных нарушений.
При болевом синдроме показано использование местной гипотермии на 15 — 20 минут каждые 4 — 6 часов.
Реабилитационные мероприятия надо начинать сразу после прекращения болевого синдрома. Их интенсивность и характер зависят от выраженности гемартроза и качества гемостаза. Возможно проведение физиотерапии и ЛФК.
Если пациент не получает постоянное профилактическое лечение, после купирования кровотечения показана кратковременная профилактика, особенно на время реабилитации.
Кровоизлияния в мышцы так же как гемартрозы сопровождаются болевым синдромом, нарушением функции
конечности. Помимо заместительной терапии рекомендована иммобилизация до купирования болевого синдрома
При болевом синдроме показано использование местной гипотермии на 15 — 20 минут каждые 4 — 6 часов.
Реабилитация, в том числе ЛФК начинаются сразу после купирования болевого синдрома. При отсутствии
постоянной профилактики, краткосрочная профилактика требуется на весь период реабилитации.
4.7.2 Кровоизлияния в ЦНС
Любая черепно-мозговая травма у пациентов с гемофилией может вести к развитию внутричерепного
кровоизлияния. Головная боль, сохраняющаяся, особенно нарастающая в течение суток, может быть
признаком внутричерепного кровоизлияния.
Даже минимальные кровоизлияния в ЦНС являются жизнеугрожающими. Требуют экстренной
госпитализации, интенсивной заместительной терапии и незамедлительного проведения диагностических
мероприятий: КТ, МРТ. Показания к оперативному лечению пациентов с гемофилией и внутричерепным
кровоизлиянием такие же как у детей с нормальным гемостазом.
4.7.3 Кровотечения из желудочно-кишечного тракта
Возникают, как правило на фоне сопутствующей патологии ЖКТ: язвенная болезнь, эрозии, полипы,
воспалительные заболевания кишечника и др. Такие кровотечения являются жизнеугрожающими и требуют
экстренной госпитализации, немедленного проведения адекватной заместительной терапии.
Необходима срочная диагностика источника кровотечения: гастроскопия, колоноскопия, УЗ исследование.
Помимо заместительной, показана терапия ингибиторами фибринолиза и лечение местного процесса,
приведшего к развитию кровотечения.
4.7.4 Почечные кровотечения
Помимо заместительной терапии показано соблюдение постельного режима, терапия кортикостероидными препаратами (преднизолон 2 мг/кг) коротким курсом 3 — 5 — 7 дней. Противопоказано применение ингибиторов фибринолиза.
Пациенты, у которых развилось почечное кровотечение должны пройти урологическое обследование.
4.7.5 Оперативное лечение больных гемофилией
Пациенты с гемофилией могут нуждаться в хирургическом лечении. В случае необходимости планового лечения подготовка должна проводиться командой, в которую входит гематолог, имеющий опыт лечения гемофилии. Оптимально, гематолог из центра, в котором наблюдается пациент. (Уровень доказательности 3).
Перед операцией необходимо провести лабораторное исследование, включающее оценку ингибитора и фармакокинетические параметры, особенно тест восстановления. Желательно наличие информации о динамике выведения препарата, используемого для заместительной терапии. (Уровень доказательности 4).
При подготовке к плановой операции необходимо обеспечить все необходимое количество препаратов для заместительной терапии на весь послеоперационный период. Непосредственно перед операцией, через 15 — 30 минут после введения концентрата фактора свертывания, необходимо провести лабораторный контроль
эффективности гемостаза. Оптимальным является определение активности факторов свертывания крови.
При невозможности (в экстренных ситуациях) необходимо оценить АЧТВ, а оставшуюся плазму законсервировать для исследования в ближайшее возможное время.
При планировании дня и времени операции необходимо учитывать требования к лабораторному контролю и возможности гематолога.
В послеоперационном периоде требуется тщательный контроль заместительной терапии, поскольку в это время возрастает потребление факторов и риск развития ингибитора даже у пациентов длительно получавших концентраты факторов свертывания и у пациентов с легкой формой гемофилии. Повышенный риск развития ингибитора сохраняется до 12 недель после операции. В этот период требуется проведение
скрининга на ингибитор. (Уровень доказательности 4).
4.7.6 Хронический синовиит
Является следствием повторных гемартрозов. Проявления:
-
Длительно сохраняющееся повышение температуры над пораженным суставом
-
Увеличение объема мягких тканей области сустава
-
Рецидивирующие кровоизлияния
-
Ограничение подвижности
Диагностика включает выявление клинических признаков, УЗИ суставов и МРТ.
Терапия проводиться совместно с ортопедами, имеющими опыт лечения больных гемофилией.
Хронический синовиит, как правило, является следствием недостаточно эффективной профилактической заместительной терапии. При выявлении признаков хронического синовиита, на первом этапе необходимо увеличить дозу заместительной терапии. Часто показана высокодозная профилактика: более 40 МЕ/кг каждые 2 дня для пациентов с гемофилией А и более 40 МЕ/кг каждые 3 дня — для пациентов с гемофилией В.
При сохранении признаков воспаления показана терапия нестероидными противовоспалительными препаратами (ингибиторами COX-2). (Уровень доказательности 2). При недостаточной эффективности, возможно проведения курса пункций сустава с введением стероидных противовоспалительных препаратов. Терапия хронического синовиита направлена на предотвращение рецидивов кровоизлияний, купирование
воспаления и сохранение (восстановление) функции сустава.
С целью восстановления функции сустава показано проведение ЛФК, физиотерапии и санаторно-курортного лечения.
При рецидивирующих кровоизлияниях, не поддающихся контролю заместительной терапией, недостаточной эффективности консервативной терапии показано проведение артроскопической, химической или радиоизотопной синовектомии.
4.7.7 Гемофилическая артропатия
Возникает вследствие прогрессирующего течения хронического синовиита и рецидивирующих кровоизлияний в суставы. Проявляется остеопорозом, нарушением структуры, истончением и потерей суставного хряща, болевым синдромом, контрактурами, мышечной атрофией, деформацией сустава.
Терапия проводиться совместно с ортопедами, имеющими опыт лечения больных гемофилией.
В основе профилактики развития артропатии — адекватная постоянная профилактическая заместительная
терапия. Своевременное лечение выявленного синовиита также необходимо для предотвращения развития
артропатии.
Диагностика артропатии основана на выявлении клинических признаков и проведении лучевых методов исследования: УЗ, КТ, МРТ.
Целью лечения является сохранение или восстановление функции сустава, борьба с болевым синдромом, атрофией мышц, поддержание или восстановление достаточной ежедневной активности пациента.
Для борьбы с болевым синдромом оптимально использовать ингибиторы COX-2. (Уровень доказательности
2).
Для восстановление функции сустава, состояния мышц проводят курсы ЛФК, физиотерапии, бальнеотерапии и курортотерапии. В ряде случаев эффективно использование тренажеров. Проводиться терапия синовиита.
При недостаточной эффективности консервативной терапии, возможно хирургическое лечение. Хирургическое лечение пациентов с гемофилией должно проводиться врачами, имеющими опыт лечения пациентов с гемофилией.
Возможны внесуставные вмешательства на мягких тканях для коррекции контрактуры, артроскопические вмешательства для удаления внутрисуставных спаек и синовектомии, химическая и радиоизотопная синовектомия и др.
4.7.8 Псевдоопухоли
Формируются вследствие недостаточно эффективного лечения гематом мягких тканей. Проявления: стабильное опухолевидное образование оттесняющее окружающие ткани. Существует на протяжении многих месяцев и лет. Не имеет тенденции к обратному развитию на фоне интенсивной заместительной терапии.
Диагностика — лучевая (МРТ) и биопсия.
Лечение проводиться совместно хирургами и гематологами. На первом этапе возможна попытка интенсивной заместительной терапии в течение 6 — 8 недель с последующим МРТ контролем. Если образование не имеет тенденции к обратному развитию показано тотальное удаление опухоли с иссечением капсулы. (Уровень доказательности 4).
Операция должна проводиться специалистами, имеющими опыт хирургического ортопедического лечения больных гемофилией.
Гемофилия у новорожденных
При решении вопроса о способе родоразрешения (вагинальные или оперативные роды), если ожидается рождение ребенка с гемофилией, необходимо выбрать наиболее атравматичный способ. (Уровень доказательности 3). Вакуумэкстракция является опасной и не должна проводиться в отношении плодов, у которых подозревается гемофилия.
После родоразрешения желательно отобрать образец пуповинной крови в пробирку с цитратом натрия для определения активности факторов свертывания крови. До момента диагностики, у новорожденных с ожидаемой гемофилией желательно воздержаться от венепункций (только для диагностики гемофилии), отбора образцов капиллярной крови и других инвазивных манипуляций.
4.8 Лечение ингибиторной гемофилии А
У пациентов с ингибиторной формой гемофилии А элиминация ингибитора возможна при проведении терапии индукции иммунной толерантности (ИИТ). (Уровень доказательности 2).
Оптимальные сроки начала ИИТ — сразу после выявления ингибитора. Однако сроки лимитируются двумя факторами: состоянием венозного доступа и титром ингибитора. Эффективность ИИТ значительно повышается, если в начале терапии титр ингибитора не превышает 10 БЕ. В случае, если титр выше указанного значения, рекомендуется прекратить инфузии фактора VIII и контролировать титр ингибитора до момента его снижения. (Уровень доказательности 2). Сохранение высокого титра ингибитора не смотря на элиминацию фактора VIII не является противопоказанием к ИИТ.
Перед началом ИИТ необходимо убедиться в доступности достаточного количества концентрата ф. VIII для его проведения.
При проведении ИИТ предпочтение отдается плазменным концентратам фактора VIII, содержащим фактор Виллебранда. (Уровень доказательности 3).
Для пациентов с высокореагирующим ингибитором, не зависимо от титра ингибитора на момент начала ИИТ рекомендована начальная схема 100 — 150 МЕ/кг каждые 12 часов.
Для пациентов с низкореагирующим ингибитором рекомендовано начинать ИИТ по схеме 50 — 100 МЕ/кг каждый второй день. Если после начала ИИТ титр ингибитора поднимется выше 5 — 7 БЕ необходимо перевести пациента на лечение по схеме, рекомендованной для ИИТ у пациентов с высокореагирующим ингибитором.
Снижение дозы и кратности введения препарата начинается после получения лабораторных данных об элиминации ингибитора (титр ингибитора — менее 0,6 БЕ, нормализация теста восстановления и периода полувыведения). Снижение проводится постепенно с постоянным лабораторным контролем. При этом каждое снижение дозы или кратности возможно только после получения лабораторных данных об отсутствии ингибитора.
После достижения дозы в 30 — 50 МЕ/кг 1 раз в 2 дня необходимо продолжить терапию по этой схеме
постоянно. Отмена профилактического лечения часто приводит к рецидиву ингибитора.
При проведении ИИТ не допустимо менять препарат концентрата ф. VIII, поскольку, это значительно ухудшает прогноз терапии.
При проведении процедуры ИИТ необходимо избегать любых воздействий и препаратов, стимулирующих иммунные реакции, в том числе вакцинации, применения препаратов интерферона и других видов иммунотерапии.
Рецидивы кровоизлияний ухудшают прогноз ИИТ, поэтому у пациентов с частыми гематрозами и массивными гематомами мягких тканей в курсе ИИТ показано проведение профилактического лечения шунтирующими препаратами до снижения титра ингибитора менее 1 БЕ.
Если в течение 8 — 12 месяцев не происходит снижения титра ингибитора, рекомендовано прекратить ИИТ, перевести пациента на терапию шунтирующими препаратами. В дальнейшем, после снижения титра ингибитора возможно повторить ИИТ с использованием другого препарата.
Профилактическое лечение у пациентов с неосложненной гемофилией
Профилактическая заместительная терапия концентратами факторов VIII или IX — необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией. (Уровень доказательности 2).
В основе метода лежат результаты исследований, показавшие, что постоянное профилактическое введение концентратов факторов VIII при гемофилии A или IX при гемофилии В, начатое до появления первого гемартроза или сразу после него позволяет предотвратить развитие гемофилической артропатии и инвалидизацию пациентов. Такое лечение называется первичная профилактика. Так же показано, что
терапия, начатая после развития рецидивирующих гемартрозов, вторичная профилактика, способствует уменьшению тяжести артропатии.
4.8.1 Организация наблюдения и лечения пациентов с коагулопатиями
Комплексный подход к лечению пациентов с бВ улучшает физическое и психологическое здоровье, качество жизни, снижает частоту развития осложнений и смертность.
Наблюдение и лечение пациентов с гемофилией и бВ должно проводится группой специалистов различного профиля, в том числе гематологом, педиатром, ортопедом, стоматологом, физиотерапевтом, врачом ЛФК, гинекологом и психологом, имеющими опыт работы с этой категорией больных.
Наблюдение больных должно быть привязано к специализированному центру. Независимо от модели, у
пациента или врачей, к которым он обращается круглосуточно должна быть возможность контакта с
гематологами, имеющими опыт лечения этой категории больных.
4.8.2 Домашнее лечение
Принцип домашнего лечения подразумевает немедленный доступ к концентратам факторов свертывания крови. Домашнее лечение позволяет обеспечить оптимальные сроки для проведения заместительной терапии. Как следствие — уменьшить выраженность нарушений, сроки восстановления и значительно сократить частоту и длительность госпитализации для лечения осложнений бВ.
При ведении пациентов с гемофилией и бВ, всегда, когда возможно должен применяться принцип домашнего лечения. Пациенты, находящиеся на домашнем лечении имеют значительно больше возможностей для ведения активного образа жизни, лучшие показатели социальной и психологической адаптации, более высокое качество жизни.
Современные препараты факторов свертывания крови как для заместительной, так и для шунтирующей терапии приспособлены для использования в рамках домашнего лечения. Домашнее лечение должно обеспечиваться специалистами команды комплексной помощи пациентам с гемофилией или бВ, в первую очередь гематологом. Однако применение этого принципа требует обучения пациента и членов его семьи.
Наиболее значимым препятствием к применению принципа домашнего лечения является обеспечение адекватного венозного доступа и возможность внутривенного введения препарата у пациентов, при невозможности использования десмопрессина. Поэтому, в случае, если члены семьи ребенка или сам ребенок, больной гемофилией или бВ не могут овладеть техникой внутривенных инъекций, необходимо обеспечить возможность проведения заместительной терапии сотрудниками ближайших медицинских учреждений.
В семьях, где проводиться домашнее лечение, должен вестись дневник с регистрацией следующих данных:
-
Дата введения препарата
-
Название и серия препарата
-
Введенная доза
-
Причина введения
-
Если препарат использован для лечения кровотечения, необходимо оценивать эффект от его введения
Противопоказания для домашнего лечения. Лечение в домашних условиях невозможно при развитии угрожающих кровотечений и кровоизлияний:
-
Внутричерепное кровоизлияние
-
Кровотечение из желудочно-кишечного тракта
-
Массивные гематомы мягких тканей
-
Кровоизлияние в глаз
-
Почечное кровотечение
-
Забрюшинная гематома
-
Любые угрожающие кровотечения и кровоизлияния, и геморрагические проявления, которые не останавливаются или рецидивируют после адекватной заместительной терапии
В этом случае, пациент должен как можно скорее обратиться к лечащему гематологу или в ближайшее медицинское учреждение для оценки состояния и оказания адекватной помощи.
4.8.3 Диспансерное наблюдение
Все пациенты, не зависимо от тяжести заболевания пожизненно находятся на диспансерном учёте.
4.8.3.1 Осмотр специалистами
-
Осмотр гематолога:
-
Пациенты с тяжелой гемофилией А и В, типом 3 бВ, все пациенты, требующие проведения
регулярной заместительной терапии — не менее 4 раз в год. -
Остальные пациенты — не реже 1 раза в год.
-
-
Осмотр ортопеда: пациенты с тяжелой формой гемофилии А и В, 3 типом бВ, все пациенты с
поражением опорно-двигательного аппарата, — не реже 1 раза в год. Остальные — по показаниям. -
Осмотр стоматолога 2 раза в год
-
Осмотр врача ЛФК — не реже 1 раза в год.
-
Школа больных гемофилией и болезнью Виллебранда — 2 раза в год
-
Осмотр гинеколога (менструирующие девушки) — не реже 1 раза в год
-
Остальные специалисты — по показаниям
4.8.3.2 Лабораторные и инструментальные обследования
-
Клинический анализ крови с подсчётом тромбоцитов и ретикулоцитов — не реже 1 раза в год
-
Биохимический анализ крови с определением маркёров поражения печении и обмена железа — не
реже 1 раза в год -
Анализ маркёров гемотрансмиссивных инфекций: гепатита В, С, ВИЧ, возможно других и гепатита
А — не реже 1 раза в год -
Анализ активности фВ и фVIII, фIХ, ингибитор ф. VIII или IX:
-
после первых 10 и 20 дней введения или не реже 1 раза в год после начала заместительной терапии
на протяжении 3 лет, -
далее, 1 раз в 1 — 3 года
-
Перед плановым оперативным лечением или инвазивными манипуляциями
-
-
Анализ показателей фармакокинетики фВ, фVIII, ф. IX:
-
При назначении постоянной профилактики 1 раз в 1 — 3 года
-
Перед плановым оперативным лечением
-
Перед назначением десмопрессина
-
В случае недостаточной эффективности применения стандартных схем заместительной терапии и
при подозрении на развитие ингибитора -
В других случаях, когда необходимо оценить эффективность заместительной терапии
-
4.8.4 Отношение к плановому хирургическому лечению
Риск планового хирургического вмешательства при достаточном обеспечении препаратами для специфической заместительной терапии незначительно превышает таковой у здоровых. Плановое хирургическое лечение не противопоказано, однако в каждом случае вопрос решается индивидуально. Проведение планового хирургического лечения допустимо только при наличии всего необходимого объема
препарата и возможности лабораторного клинического контроля эффективности гемостаза.
Перед плановым хирургическим вмешательством необходимо:
-
Проверить пациента на наличие ингибитора (при 3 типе)
-
Провести анализ фармакокинетических показателей
При проведении хирургического лечения необходимо проводить максимально тщательный механический (хирургический) гемостаз. При выборе методов хирургического лечения необходимо учитывать это требование и возможность минимализации операционной раны.
У пациентов с сомнительным диагнозом, оперативное лечение допустимо проводить без предшествующей заместительной терапии. При этом необходимо динамическое наблюдение гематолога для оперативного решения вопроса о назначении заместительной терапии в случае развития кровотечения. Исключение составляют операции с высоким риском кровотечения, когда вопрос о заместительной терапии должен решаться индивидуально.
Нежелательная медикаментозная терапия
Пациентам с гемофилией нежелательно применение препаратов, ухудшающих функцию тромбоцитов или свертывания крови. Применение антикоагулянтов и дезагрегантов может привести может привести к тяжёлым геморрагическим проявлениям. Возможность их применения необходимо согласовывать с гематологом. В этом случае, пациентам необходимо проводить специфическую заместительную терапию по профилактическим схемам.
Однако развившийся тромбоз может потребовать применения антикоагулянтов. Предпочтение надо отдавать препаратам кратковременного действия. Каждый раз необходимо анализировать соотношение пользы и риска от применения антикоагулянтов и дезагрегантов.
4.8.5 Вакцинация
Пациенты с гемофилией и бВ могут быть вакцинированы. Особенно важно проведение вакцинации от гепатита В. При вакцинации предпочтение отдается оральному или подкожному введению препарата, по сравнению с внутримышечным или внутрикожным. (Уровень доказательности 4). Если для данной вакцины доступен только внутримышечный путь введения, пациента м с тяжелой и среднетяжелой гемофилией,
тяжелым течением бВ необходима заместительная терапия для предотвращения развития гематомы. Оптимально проведение вакцинации через сутки после введения концентрата фактора.
Вопрос о вакцинации пациентов с ингибиторной формой гемофилии каждый раз решается индивидуально. Вакцинация противопоказана пациентам, получающим курс индукции иммунной толерантности. Помимо стандартных прививок, пациентов с коагулопатиями рекомендуется привить от гепатита А до достижения 6 — 7 лет.
4.8.6 Возможность пребывания в организованном коллективе
Как правило, все дети могут посещать школу. Однако, каждый раз вопрос должен решаться индивидуально с учётом особенностей ребёнка родителями (опекунами) и лечащим гематологом.
Во всех случаях администрация детского учреждения должна быть предупреждена о диагнозе ребёнка и иметь выписку с рекомендациями от лечащего гематолога.
4.8.7 Санаторно-курортное лечение
Детям с поражением опорно-двигательного аппарата показано санаторно-курортное лечение в санаториях ортопедического профиля, особенно в условиях морских курортов. Наиболее эффективна бальнеотерапия и ЛФК.
Физическая активность
Достаточная физическая активность необходима пациентам с гемофилией для адекватного развития опорно-двигательного аппарата, нервной системы, поддержания общего здоровья организма и самоуважения пациента. Акцент необходимо делать на укрепление силы мышц, разработку координации движения и общую физическую активность.
У пациентов с гемофилией и бВ, особенно страдающих значимыми нарушениями функции опорно-двигательного аппарата восстановление адекватной физической активности способствует нормализации плотности костной ткани и улучшению состояния суставов.
При выборе занятий необходимо учитывать физическое состояние пациента, его подготовленность, индивидуальные предпочтения и интересы и доступность. Предпочтение надо отдавать таким видам, как бадминтон, плавание, гребля, стрельба из лука, настольный теннис, парусный спорт, гольф и др. Осторожно
надо относиться к велоспорту, лыжам, конькам, играм с нетяжелым мячом. Такие занятия требуют достаточного гемостатического обеспечения. Наиболее опасны контактные виды единоборств, горные виды спорта, футбол, хоккей, регби. Эти виды
сопряжены с высоким риском травм, опасных для жизни.
Пациенты с имеющимися нарушениями опорно-двигательного аппарата должны проходить курсы лечебной физкультуры. В разработке курса должны принимать участие специалисты ЛФК совместно с гематологами, имеющие опыт лечения этой категории больных.
4.9 Обучение пациентов и членов их семей
Обучение пациентов и членов их семей — необходимое условие обеспечения адекватной помощи таким больным. Обучение начинается сразу после установления диагноза и проводиться на постоянной основе врачами и медицинскими сестрами центра, в котором наблюдается пациент.
Обучение проводиться индивидуально при посещении центра и в рамках школы больного гемофилией и бВ.
Основные направления обучения пациента и членов его семьи:
-
что такое гемофилия, бВ;
-
особенности детей, больных гемофилией, бВ;
-
навыки оценки состояния ребенка;
-
навыки оценки симптомов, характера и тяжести кровотечения;
-
хранение и использование концентратов факторов свертывания крови;
-
показания и дозы заместительной терапии;
-
навыки проведения инфузии в домашних условиях;
-
уход за венами;
-
применение других гемостатических препаратов;
-
физическая активность;
-
психологическая и социальная адаптация;
-
профессиональная ориентация;
-
юридические аспекты.
Помимо врачей и медсестер к обучению пациентов и членов их семей необходимо привлекать психологов, юристов и членов общественных организаций, представляющих интересы больных гемофилией, бВ.
4.10 Характеристика требований
4.10.1 Модель пациента 1. Гемофилия А не осложненная развитием ингибитора.
|
Обязательная составляющая модели |
Описание составляющей |
|
Нозологическая форма |
Гемофилия А |
|
Стадия заболевания |
Нет |
|
Фаза заболевания |
Нет |
|
Осложнения |
Система органов кроветворения и кровь: анемия. Органы зрения: кровоизлияние в структуры глаза. |
|
Код по МКБ-10 |
D66 |
4.10.2 Критерии и признаки, определяющие модель пациента
Данные семейного анамнеза: примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по женской линии (у мужчин, реже у женщин).
Данные личного анамнеза: геморрагические проявления. В том числе кожный гемосиндром, гематомы мягких тканей, отсроченные кровотечения, длительные посттравматические кровотечения, кровоизлияния в суставы и их маски.
Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и (или) множественные гематомы, системность геморрагических проявлений (проявления различной локализации), «спонтанные геморрагические проявления», возникающие из-за
длительного латентного периода и несоответствия тяжести проявления тяжести травмы.
При лабораторном обследовании выявляется снижение активности фактора VIII менее 50%, ингибитор ф.
VIII отрицательный, активность ФВ не снижена.
4.10.3 Перечень медицинских услуг основного и дополнительного ассортимента
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для диагностики и лечения в стационаре представлен в таблице 1.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A03.16.001 |
Эзофагогастродуоденоскопия |
0,050 |
1,000 |
|
A03.18.001 |
Толстокишечная эндоскопия |
0,050 |
1,000 |
|
A03.19.002 |
Ректороманоскопия |
0,050 |
1,000 |
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,10 |
2,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,9 |
2,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,900 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,10 |
2,000 |
|
A05.04.001 |
Магнитно- резонансная томография суставов (один |
0,050 |
1,000 |
|
A05.10.002 |
Проведение электрокардиографических |
0,050 |
1,000 |
|
A05.14.001 |
Магнитно-резонансная томография органов брюшной |
0,050 |
1,000 |
|
A05.23.001 |
Электроэнцефалография |
0,150 |
1,000 |
|
A05.23.009 |
Магнитно-резонансная томография головного мозга |
0,050 |
1,0 |
|
A05.30.007 |
Магнитно-резонансная томография забрюшиного |
0,010 |
1,000 |
|
A05.30.008 |
Магнитно-резонансная томография шеи |
0,01 |
1,000 |
|
A06.03.002.003 |
Спиральная компьютерная томография головы |
0,050 |
1,000 |
|
A06.03.028 |
Рентгенография плечевой кости |
0,050 |
1,000 |
|
A06.03.029 |
Рентгенография локтевой кости и лучевой кости |
0,050 |
1,000 |
|
A06.03.032 |
Рентгенография кисти руки |
0,050 |
1,000 |
|
A06.03.043 |
Рентгенография бедренной кости |
0,050 |
1,000 |
|
A06.03.046 |
Рентгенография большой берцовой и малой берцовой |
0,050 |
1,000 |
|
A06.03.053 |
Рентгенография стопы в двух проекциях |
0,050 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,050 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,050 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,050 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,050 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,050 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,050 |
1,000 |
|
A06.28.002 |
Внутривенная урография |
0,01 |
1,000 |
|
A06.30.007 |
Компьютерная томография забрюшинного |
0,01 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,500 |
1,000 |
|
A09.05.049 |
Исследование уровня факторов свертывания в крови |
0,1 |
1 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,1 |
1 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,500 |
1,000 |
|
A09.05.187 |
Определение активности фактора IX в сыворотке |
0,10 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в сыворотке |
0,50 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в сыворотке |
0,1 |
12 |
|
A09.28.001 |
Микроскопическое исследование осадка мочи |
0,1 |
2,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,7 |
2 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,3 |
12 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,05 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,05 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,50 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,50 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,30 |
1,000 |
|
A12.05.016 |
Исследование свойств сгустка крови |
0,30 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,050 |
3,000 |
|
A12.05.027 |
Определение протромбинового (тромбопластинового) |
0,05 |
1,0 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,05 |
1,0 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,3 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к фактору VIII в |
0,3 |
1 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,050 |
1,000 |
|
A26.06.040 |
Определение антител классов M, G (IgM, IgG) к |
0,100 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
0,3 |
1,000 |
|
A26.06.043 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,300 |
1,000 |
|
A26.06.044 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,300 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,3 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,3 |
1,000 |
|
B01.003.001 |
Осмотр (консультация) врачом-анестезиологом- |
0,050 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
0,1 |
1,000 |
|
B01.005.003 |
Ежедневный осмотр врачом-гематологом с |
1,0 |
18,000 |
|
B01.010.001 |
Прием (осмотр, консультация) врача-детского хирурга |
0,050 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,050 |
1,000 |
|
B01.023.001 |
Прием (осмотр, консультация) врача- невролога |
0,010 |
1,000 |
|
B01.028.001 |
Прием (осмотр, консультация) врача- |
0,050 |
1,000 |
|
B01.031.001 |
Прием (осмотр, консультация) врача-педиатра |
0,1 |
1,000 |
|
B01.047.007 |
Прием (осмотр, консультация) врача приемного |
0,1 |
1,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – травматолога- |
0,05 |
1,000 |
|
B01.050.002 |
Прием (осмотр, консультация) врача – травматолога- |
0,1 |
3,000 |
|
B01.053.001 |
Прием (осмотр, консультация) врача-уролога |
0,050 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,30 |
2,000 |
|
B01.067.001 |
Прием (осмотр, консультация) врача-стоматолога- |
0,050 |
1,000 |
|
B03.005.006 |
Коагулограмма (ориентировочное исследование |
0,3 |
1 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,0 |
2,000 |
|
B03.016.004 |
Анализ крови биохимический общетерапевтический |
1,0 |
1,0 |
|
B03.016.006 |
Анализ мочи общий |
1,0 |
1 |
|
A12.05.035.004 |
Специфический тест способности фактора |
0,010 |
1,000 |
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для оказания специализированной амбулаторной помощи представлен в таблице 2.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,100 |
2,000 |
|
A04.04.001 |
Ультразвуковое исследование сустава |
0,050 |
1,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,5 |
1,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,500 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,050 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,10 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,10 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,100 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,010 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,100 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,100 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,2 |
1,000 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,300 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,200 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в |
0,300 |
11,000 |
|
A11.05.001 |
Взятие крови из пальца |
1,000 |
1,000 |
|
A11.12.003 |
Внутривенное введение лекарственных |
0,100 |
160,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
1,000 |
4,000 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,050 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,050 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,050 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,200 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,010 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,300 |
4,000 |
|
A12.05.027 |
Определение протромбинового |
0,500 |
1,000 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,500 |
1,000 |
|
A12.05.035 |
Исследование активности и свойств фактора |
0,200 |
1,000 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,500 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к фактору |
0,500 |
1,000 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,300 |
1,000 |
|
A13.29.003 |
Психологическая адаптация |
0,100 |
1,000 |
|
A13.29.007 |
Психологическая коррекция |
0,100 |
1,000 |
|
A13.29.011 |
Социально-реабилитационная работа |
0,500 |
1,000 |
|
A14.12.001 |
Уход за сосудистым катетером |
0,010 |
160,000 |
|
A19.04.001 |
Лечебная физкультура при заболеваниях и |
0,100 |
90,000 |
|
A19.05.001 |
Лечебная физкультура при заболеваниях системы |
0,900 |
120,000 |
|
A20.30.001 |
Ванны минеральные |
0,300 |
10,000 |
|
A20.30.012 |
Воздействие климатом |
0,500 |
21,000 |
|
A26.06.034 |
Определение антител классов M, G (IgG, IgM) к |
1,000 |
1,000 |
|
A26.06.036 |
Определение антигена к вирусу гепатита В |
1,000 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.063 |
Определение антител классов M, G (IgM, IgG) к |
0,500 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
1,000 |
|
B01.005.002 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
11,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,800 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,500 |
2,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – |
0,800 |
1,000 |
|
B01.050.002 |
Прием (осмотр, консультация) врача – |
0,300 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,500 |
2,000 |
|
B01.064.003 |
Прием (осмотр, консультация) врача- стоматолога |
0,800 |
1,000 |
|
B01.064.004 |
Прием (осмотр, консультация) врача-стоматолога |
0,500 |
2,000 |
|
B02.069.001 |
Прием (тестирование, консультация) |
0,500 |
1,000 |
|
B02.069.002 |
Прием (тестирование, консультация) |
0,200 |
3,000 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,000 |
1,000 |
|
B03.016.004 |
Анализ крови биохимический |
0,100 |
1,000 |
|
B03.016.006 |
Анализ мочи общий |
0,100 |
1,000 |
|
B04.020.001 |
Диспансерный прием (осмотр, консультация) |
0,200 |
2,000 |
|
B04.020.002 |
Профилактический прием (осмотр, консультация) |
0,100 |
2,000 |
|
B04.069.001 |
Школа психологической профилактики для |
0,900 |
2,000 |
4.10.4 Характеристика алгоритмов и особенностей применения медицинских услуг при данной модели пациента
Физикальное обследование
Направлено на выявление геморрагических симптомов и дает основания для проведения дополнительных обследований: УЗДГ, КТ, рентгенографии, МРТ. Кроме того, позволяет заподозрить такие осложнения, как анемия, поражение печени, поражение опорно-двигательного аппарата.
Лабораторная диагностика
Первичная лабораторная диагностика проводится этапно:
Первый этап. Коагулологический скрининг при подозрении на геморрагические состояния:
-
активированное парциальное (частичное) тромбопластиновое время (АЧТВ, АПТВ)
-
протромбиновое время (ПВ)
-
тромбиновое время (ТВ)
-
количество фибриногена (по Клаусу)
-
время кровотечения стандартизованным методом (например, по Айви) или инструментальная оценка функции тромбоцитов
Второй этап. Выполняется при изолированном удлинении АЧТВ, либо при отсутствии изменения в скрининге и наличии клинических признаков лёгкой формы гемофилии.
-
тест коррекции (коррекция АЧТВ при смешивании плазмы пациента с нормальной плазмой)
-
активность ф VIII
-
активность ф. IX
-
ристоцетин кофакторная активность (активность фВ)
-
активность ф. XI
-
активность ф. ХII
Третий этап. Выполняется при выявленном снижении активности ф. VIII.
-
определение специфического ингибитора к ф.VIII.
-
определение неспецифического ингибитора (волчаночного антикоагулянта) выполняется при снижении активности нескольких факторов свёртывания крови, удлинении липид-зависимых тестов (АЧТВ с чувствительными реактивами)
Диагноз и тяжесть гемофилии устанавливаются после выявления снижения активности фактора VIII и при отсутствии данных за приобретенное геморрагическое состояние, связанное с появлением ингибитора.
Контрольные коагулологические обследования.
Проводятся для уточнения формы заболевания, контроля развития осложнений и контроля эффективности фармакотерапии. Их режим описан выше.
-
Плановый контроль: АЧТВ, ПВ, ТВ, фибриноген, активность ф. VIII, ингибитор ф. VIII.
Выполняется не реже 1 раза в 3 года. -
Контроль ингибитора: АЧТВ, ПВ, ТВ, фибриноген, активность ф. VIII, ингибитор ф. VIII.
Выполняется:-
Пациентам с тяжелой и среднетяжелой гемофилией А каждые 5 – 10 дней введения
концентрата ф. VIII на протяжении первых 20 – 50 дней введения. -
Пациентам не зависимо от тяжести гемофилии перед плановым хирургическим лечением.
-
При появлении клинических или лабораторных данных за развитие ингибитора.
-
-
Контроль эффективности фармакотерапии: активность ф.VIII, ингибитор ф. VIII (если не выполнялся ранее или есть подозрение на его развитие), тест восстановления, построение фармакокинетической кривой. Выполняется при подозрении на низкореагирующий ингибитор, при недостаточной эффективности адекватных доз препарата, для подбора оптимальной схемы
профилактической заместительной терапии.
Дополнительные лабораторные обследования направлены на диагностику осложнений и сопутствующих состояний:
-
Биохимический анализ крови для оценки состояния печени выполняется 1 раз в год планово и при подозрении на развитие гепатита.
-
Биохимический анализ крови для оценки обмена железа показан при развитии анемии, детям первых трех лет жизни (не реже 1 раза в год), пациентам, страдающим повторными или массивными кровотечениями.
Инструментальная диагностика.
При наличии признаков поражения опорно-двигательного аппарата показана консультация ортопеда или травматолога. В дальнейшем проводится рентгенологическое исследование или МРТ пораженной области, гониометрия, УЗИ суставов, забрюшинного пространства (при подозрении на забрюшинные гематомы), УЗИ мышц.
При подозрении на гематомы мягких тканей любой локализации, псевдоопухоли, кровотечения в полости организма необходимо проводить наиболее информативные методы лучевой диагностики. Решение о применении того или иного метода необходимо принимать после консультации со специалистами лучевой
диагностики, хирургами и травматологами.
Подозрение на кровотечение из органов желудочно-кишечного тракта требует выполнения ультразвукового обследования органов брюшной полости и почек, эндоскопических методов исследования.
При признаках гематурии необходимо УЗИ органов мочевыводящей системы и, возможно, дополнительное рентгеноконтрастное исследование, КТ или МРТ.
4.10.5 Требования к лекарственной помощи
Перечень лекарственных препаратов для оказания стационарной помощи приведен в таблице 3.
| Фармакотера певическая группа | Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Факторы свертывания крови |
Кровь и система кроветворения |
Фактор свертывания крови VIII + Фактор Виллебранда |
0,1 |
6000 МЕ |
120000 МЕ |
|
Факторы свертывания крови |
Кровь и система кроветворения |
Фактор свертывания крови VIII, октаког альфа, |
0,9 |
6000 МЕ |
120000 МЕ |
|
Гидрокортизон |
0,200 |
50 мг |
150 мг |
||
|
Преднизолон |
0,070 |
120 мг |
1200 мг |
||
|
Эритромасса с удаленным |
0,050 |
500 мл |
500 мл |
||
|
Отмытые эритроциты |
0,050 |
500 мл |
500 мл |
||
|
Свежезамороженная |
0,050 |
500 мл |
500 мл |
||
|
Бетаметазон |
0,050 |
5 мг |
15 мг |
||
|
Железа сульфат |
0,200 |
100 мг |
1500 мг |
||
|
Железа {III} гидроксид |
0,200 |
100 мг |
1500 мг |
||
|
Аминокапроновая кислота |
0,5 |
6000 мг |
42000 мг |
||
|
Транексамовая кислота |
0,5 |
1200 мг |
16800 мг |
Перечень лекарственных препаратов для амбулаторного ведения пациентов представлен в таблице 4.
| Фармакотера певическая группа | Анатомо-терапевтическая химическая группа | Международное непатентированное наименование | Частота назначений | Ориентировочная суточная доза | Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Факторы свертывания крови |
Кровь и система кроветворения |
Фактор свертывания крови VIII + Фактор Виллебранда |
0,1 |
2000 МЕ |
316000 МЕ |
|
Факторы свертывания крови |
Кровь и система кроветворения |
Фактор свертывания крови VIII, октаког альфа, |
0,7 |
2000 МЕ |
3160000 МЕ |
|
Фактор свертывания крови |
0.2 |
2000 |
48000 |
||
|
Железа сульфат |
0,200 |
100 мг |
1500 мг |
||
|
Транексамовая кислота |
0,5 |
1200 мг |
60000 мг |
Приведенные в форме суточная и эквивалентная курсовая дозы препаратов являются ориентировочной
величиной. В каждом конкретном случае доза препаратов должна быть подобрана пациенту индивидуально с
учетом массы тела, особенностей фармакокинетики и фармакодинамики у данного пациента.
4.10.6 Характеристики алгоритмов и особенностей применения медикаментов
4.10.6.1 Способы введения препаратов свертывания крови
Концентраты факторов свертывания крови вводятся внутривенно. Чаще всего используется болюсная инфузия со скоростью, рекомендованной производителем.
Поскольку разведенный препарат может долго сохранять активность в растворе, возможно применение непрерывной инфузии. Последнее позволяет снизить расход и избежать значимых колебаний активности в крови. Применение непрерывной инфузии показано пациентам, перенесшим большие операции или
проходящим лечение по поводу тяжелых травм, соблюдающим постельный режим.
4.10.6.2 Дозы и кратность введения при неосложненной гемофилии
Во всех случаях необходимо сразу использовать достаточную дозу и кратность введения препаратов. Использование неадекватно низкой дозы и кратности приводит к снижению эффективности, ухудшению
состояния и увеличению расхода препаратов.
Неадекватно высокая доза может привести к развитию тромбозов и всегда неоправданно повышает расход.
Препараты факторов свертывания крови расфасованы дискретными дозами. Учитывая их высокую стоимость после получения расчетной дозы необходимо вводить дозу, приближенную к результату расчета, КРАТНУЮ СОДЕРЖАНИЮ ПРЕПАРАТА В 1 ФЛАКОНЕ. Исключением может быть заместительная терапия у новорожденных и детей первых месяцев жизни.
Расчет дозы концентратов фактора VIII проводится исходя из целевого значения активности дефицитного фактора при тех или иных состояниях и периода полувыведения препарата.
Имеющиеся индивидуальные колебания фармакокинетических параметров у каждого пациента требуют индивидуальной оценки фармакокинетической кривой. В случае, если у пациента такой анализ проведен, расчет дозы и кратности введения должен проводиться с учетом имеющихся данных.
Необходимо учитывать, что у пациентов с продолжающейся кровопотерей, с тяжелой травмой или перенесших большое оперативное вмешательство период полувыведения препарата, как правило, укорачивается.
При отсутствии данных об индивидуальных особенностях фармакокинетики, возможно использование усредненных значений, приведенных ниже.
Период полувыведения фактора VIII составляет около 8 — 12 часов.
При введении 1 МЕ/кг массы тела пациента активность фактора VIII повышается, в среднем на 2% (у детей старше года) (восстановление активности ф VIII — тест восстановления = 2). У детей первого года жизни степень повышения активности ф. VIII может быть меньше — 1%.
Расчет дозы концентрата фактора VIII у детей старшего возраста:
Доза (МЕ) = масса тела х (требуемая активность — базальная активность) х 0,5.
Расчет дозы концентрата фактора VIII у детей первого года жизни:
Доза (МЕ) = масса тела х (требуемая активность — базальная активность).
Расчет препаратов для непрерывной инфузии.
У пациентов с неосложненной гемофилией А непрерывное введение концентрата ф. VIII со скоростью 4 — 6 МЕ/кг в час может поддерживать активность этого фактора в крови на уровне 100% при условии отсутствия активного потребления на фоне кровотечения или после массивных травм и операций.
При организации непрерывной инфузии необходимо помнить, что различные препараты имеют различную устойчивость в растворе. Информация должна предоставляться компанией-производителем.
У детей первых 3 – 5 лет жизни оптимально каждый раз разводить 1 флакон препарата, вводить его и разводить следующий только после окончания введения предыдущего. В любом случае нежелательно вводить разведенный препарат дольше 6 — 8 часов (если производитель не указал иное). (Уровень доказательности 4).
Непрерывная инфузия требует динамического лабораторного контроля.
Определение активности вводимого фактора показано перед началом инфузии, далее 1 раз в 8-12 часов. Если показатели стабильны на протяжении нескольких тестов, контроль возможно проводить 1 раз в 1 — 2 дня. Помимо лабораторного контроля требуется динамический клинический контроль.
Рекомендации по клиническому и лабораторному контроля приведены выше.
Рекомендации по требуемому уровню активности факторов и длительности терапии при неосложненной гемофилии приведены в таблице 5. Данная информация является ориентировочной. После остановки первичного кровотечения должна проводиться профилактика с целью предотвращения рецидивов и неосложненного восстановления. Решение о прекращении заместительной терапии должно приниматься с
учетом имеющихся рекомендаций. Терапию можно прекратить после завершения процесса рубцевания, рассасывания гематомы и восстановления функции.
Назначение концентрата ф. VIII с фВ показано пациентам, прошедшим индукцию иммунной толерантности или пациентам, у которых препараты ф. VIII, не содержащие фВ не обеспечивают достаточно эффективный гемостаз. Остальные пациенты могут получать плазменные и рекомбинантные концентраты ф.VIII, которые
не содержат фВ или содержат в низкой концентрации.
При амбулаторном ведении, около 70% пациентов с гемофилией А показана постоянная профилактическая заместительная терапия. Рекомендации по дозированию препаратов приведены выше. В таблице указаны средние профилактические дозы на пациента массой тела 50 кг и разовой дозой 40 МЕ/кг.
Около 20% пациентов получают лечение по требованию. Это пациенты с легкой и среднетяжелой гемофилией А, которые не страдают рецидивирующими кровоизлияниями в элементы опорно-двигательного аппарата.
4.10.6.3 Лабораторный контроль терапии
Лабораторный контроль у пациентов, получающих терапию по поводу кровотечения или кровоизлияния заключается в анализе остаточной активности фактора перед следующим введением, анализа наличия ингибитора.
4.10.7 Требования к режиму труда, отдыха, лечения или реабилитации
Ограничения в соответствии с текущим статусом пациента
4.10.8 Требования к уходу за пациентом и вспомогательным процедурам
Соблюдение пациентами правил личной гигиены. Требования в соответствии с текущим статусом.
4.10.9 Требования к диетическим назначениям и ограничениям
При наличии аллергоанамнеза исключать причинно-значимые продукты.
При кровотечениях из ран слизистой рта показан протертый стол.
При кровотечениях из желудочно-кишечного тракта показана диета, соответствующая установленному гастроэнтерологическому диагнозу.
4.10.10 Особенности информированного добровольного согласия пациента при выполнении протокола ведения больных и дополнительная информация для пациента и членов его семьи
Информированное добровольное согласие пациент (опекун пациента) дает в письменном виде.
Пациенту (опекуну) следует объяснить необходимость и правила режима, диеты, необходимость фармакологической интервенции.
4.10.11 Правила изменения требований при выполнении протокола и прекращение действия требований протокола
Протокол перестает действовать при выявлении ингибитора ф.VIII. При развитии ингибитора медицинская помощь пациенту оказывается в соответствии с требованиями соответствующего протокола.
4.10.12 Возможные исходы и их характеристика
Возможные исходы гемофилии А и их характеристика представлены в таблице 5.
| Наименование исхода | Частота развития, % |
Критерии и признаки | Ориентировочное время достижения исхода, лет | Преемственность и этапность оказания медицинской помощи |
|---|---|---|---|---|
|
Летальный исход |
Менее 0,1% |
Наступление смерти в результате геморрагических осложнений |
– |
|
|
Развитие гемофилической артропатии |
5% |
Рентгенологические и клинические признаки артроза суставов: коленные, |
14 – 16 лет |
4.11 Модель пациента 2. Гемофилия А, осложненная развитием ингибитора.
|
Обязательная составляющая модели |
Описание составляющей |
|
Нозологическая форма |
Гемофилия А |
|
Стадия заболевания |
Нет |
|
Фаза заболевания |
Нет |
|
Осложнения |
Система органов кроветворения и кровь: анемия, |
|
Код по МКБ-10 |
D66 |
4.11.1 Критерии и признаки, определяющие модель пациента
Данные семейного анамнеза: примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по женской линии (у мужчин, реже у женщин).
Данные личного анамнеза: геморрагические проявления. В том числе кожный гемосиндром, гематомы мягких тканей, отсроченные кровотечения, длительные посттравматические кровотечения, кровоизлияния в суставы и их маски.
Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и (или) множественные гематомы, системность геморрагических проявлений
(проявления различной локализации), «спонтанные геморрагические проявления», возникающие из-за длительного латентного периода и несоответствия тяжести проявления тяжести травмы.
При лабораторном обследовании выявляется снижение активности фактора VIII менее 50%, ингибитор ф.
VIII положительный, активность ФВ не снижена.
4.11.2 Перечень медицинских услуг основного и дополнительного ассортимента
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для диагностики и лечения в стационаре представлен в таблице 6.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A03.16.001 |
Эзофагогастродуоденоскопия |
0,050 |
1,000 |
|
A03.18.001 |
Толстокишечная эндоскопия |
0,050 |
1,000 |
|
A03.19.002 |
Ректороманоскопия |
0,050 |
1,000 |
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,50 |
2,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,90 |
2,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,900 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,050 |
2,000 |
|
A05.04.001 |
Магнитно- резонансная томография суставов (один |
0,050 |
1,000 |
|
A05.10.002 |
Проведение электрокардиографических |
0,50 |
1,000 |
|
A05.23.001 |
Электроэнцефалография |
0,050 |
1,000 |
|
A05.23.009 |
Магнитно-резонансная томография головного мозга |
0,050 |
1,0 |
|
A05.30.007 |
Магнитно-резонансная томография забрюшиного |
0,010 |
1,000 |
|
A06.03.002.003 |
Спиральная компьютерная томография головы |
0,10 |
1,000 |
|
A06.03.028 |
Рентгенография плечевой кости |
0,050 |
1,000 |
|
A06.03.029 |
Рентгенография локтевой кости и лучевой кости |
0,050 |
1,000 |
|
A06.03.032 |
Рентгенография кисти руки |
0,050 |
1,000 |
|
A06.03.043 |
Рентгенография бедренной кости |
0,050 |
1,000 |
|
A06.03.046 |
Рентгенография большой берцовой и малой берцовой |
0,050 |
1,000 |
|
A06.03.053 |
Рентгенография стопы в двух проекциях |
0,050 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,050 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,050 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,050 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,050 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,050 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,050 |
1,000 |
|
A06.28.002 |
Внутривенная урография |
0,05 |
1,000 |
|
A06.30.007 |
Компьютерная томография забрюшинного |
0,5 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,5 |
1,000 |
|
A09.05.049 |
Исследование уровня факторов свертывания в крови |
0,8 |
1 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,8 |
1 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,500 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в сыворотке |
0,50 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в сыворотке |
0,2 |
6 |
|
A09.28.001 |
Микроскопическое исследование осадка мочи |
0,10 |
1,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,7 |
2 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,3 |
6 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,1 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,1 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,1 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,50 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,050 |
1,000 |
|
A12.05.016 |
Исследование свойств сгустка крови |
0,050 |
2,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,050 |
3,000 |
|
A12.05.027 |
Определение протромбинового (тромбопластинового) |
0,5 |
1,0 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,5 |
1,0 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,5 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к фактору VIII в |
0,5 |
1 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,050 |
1,000 |
|
A26.06.040 |
Определение антител классов M, G (IgM, IgG) к |
0,5 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
0,5 |
1,000 |
|
A26.06.043 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
A26.06.044 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
B01.003.001 |
Осмотр (консультация) врачом-анестезиологом- |
0,050 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
1,0 |
1,000 |
|
B01.005.003 |
Ежедневный осмотр врачом-гематологом с |
1,0 |
25,000 |
|
B01.010.001 |
Прием (осмотр, консультация) врача-детского хирурга |
0,050 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,30 |
1,000 |
|
B01.023.001 |
Прием (осмотр, консультация) врача- невролога |
0,050 |
1,000 |
|
B01.028.001 |
Прием (осмотр, консультация) врача- |
0,050 |
1,000 |
|
B01.031.001 |
Прием (осмотр, консультация) врача-педиатра |
0,5 |
1,000 |
|
B01.047.007 |
Прием (осмотр, консультация) врача приемного |
1,0 |
1,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – травматолога- |
0,5 |
1,000 |
|
B01.053.001 |
Прием (осмотр, консультация) врача-уролога |
0,050 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,5 |
2,000 |
|
B01.067.001 |
Прием (осмотр, консультация) врача-стоматолога- |
0,10 |
1,000 |
|
B03.005.006 |
Коагулограмма (ориентировочное исследование |
0,5 |
1 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,0 |
2,000 |
|
B03.016.004 |
Анализ крови биохимический общетерапевтический |
1,0 |
0,1 |
|
B03.016.006 |
Анализ мочи общий |
1,0 |
1 |
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для оказания специализированной амбулаторной помощи представлен в таблице 7.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,100 |
2,000 |
|
A04.04.001 |
Ультразвуковое исследование сустава |
0,050 |
1,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,5 |
1,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,500 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,010 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,10 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,10 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,100 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,010 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,100 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,100 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,2 |
1,000 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,300 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,200 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в |
0,300 |
11,000 |
|
A11.05.001 |
Взятие крови из пальца |
1,000 |
1,000 |
|
A11.12.003 |
Внутривенное введение лекарственных |
0,100 |
160,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
1,000 |
4,000 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,050 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,050 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,050 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,200 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,010 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,300 |
4,000 |
|
A12.05.027 |
Определение протромбинового |
0,500 |
1,000 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,500 |
1,000 |
|
A12.05.035 |
Исследование активности и свойств фактора |
0,200 |
1,000 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,500 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к фактору |
0,500 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к фактору |
0,3 |
24,0 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,300 |
1,000 |
|
A13.29.003 |
Психологическая адаптация |
0,100 |
1,000 |
|
A13.29.007 |
Психологическая коррекция |
0,100 |
1,000 |
|
A13.29.011 |
Социально-реабилитационная работа |
0,500 |
1,000 |
|
A14.12.001 |
Уход за сосудистым катетером |
0,010 |
160,000 |
|
A19.04.001 |
Лечебная физкультура при заболеваниях и |
0,100 |
90,000 |
|
A19.05.001 |
Лечебная физкультура при заболеваниях системы |
0,900 |
120,000 |
|
A20.30.001 |
Ванны минеральные |
0,300 |
10,000 |
|
A20.30.012 |
Воздействие климатом |
0,500 |
21,000 |
|
A24.01.002 |
Наложение компресса на кожу |
0,100 |
160,000 |
|
A26.06.034 |
Определение антител классов M, G (IgG, IgM) к |
1,000 |
1,000 |
|
A26.06.036 |
Определение антигена к вирусу гепатита В |
1,000 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.063 |
Определение антител классов M, G (IgM, IgG) к |
0,500 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
1,000 |
|
B01.005.002 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
11,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,800 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,500 |
2,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – |
0,800 |
1,000 |
|
B01.050.002 |
Прием (осмотр, консультация) врача – |
0,300 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,500 |
2,000 |
|
B01.064.003 |
Прием (осмотр, консультация) врача- стоматолога |
0,800 |
1,000 |
|
B01.064.004 |
Прием (осмотр, консультация) врача-стоматолога |
0,500 |
2,000 |
|
B02.069.001 |
Прием (тестирование, консультация) |
0,500 |
1,000 |
|
B02.069.002 |
Прием (тестирование, консультация) |
0,200 |
3,000 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,000 |
1,000 |
|
B03.016.004 |
Анализ крови биохимический |
0,100 |
1,000 |
|
B03.016.006 |
Анализ мочи общий |
0,100 |
1,000 |
|
B04.020.001 |
Диспансерный прием (осмотр, консультация) |
0,200 |
2,000 |
|
B04.020.002 |
Профилактический прием (осмотр, консультация) |
0,100 |
2,000 |
|
B04.069.001 |
Школа психологической профилактики для |
0,900 |
2,000 |
4.11.3 Характеристика алгоритмов и особенностей применения медицинских услуг при данной модели пациента
Физикальное обследование
Направлено на выявление геморрагических симптомов и дает основания для проведения дополнительных обследований: УЗДГ, КТ, рентгенографии, МРТ. Кроме того, позволяет заподозрить такие осложнения, как анемия, поражение печени, поражение опорно-двигательного аппарата.
Лабораторная диагностика
Первичная лабораторная диагностика проводится этапно:
Первый этап. Коагулологический скрининг при подозрении на геморрагические состояния:
-
активированное парциальное (частичное) тромбопластиновое время (АЧТВ, АПТВ)
-
протромбиновое время (ПВ)
-
тромбиновое время (ТВ)
-
количество фибриногена (по Клаусу)
-
время кровотечения стандартизованным методом (например, по Айви) или инструментальная оценка функции тромбоцитов
Второй этап. Выполняется при изолированном удлинении АЧТВ, либо при отсутствии изменения в скрининге и наличии клинических признаков лёгкой формы гемофилии.
-
тест коррекции (коррекция АЧТВ при смешивании плазмы пациента с нормальной плазмой)
-
активность ф VIII
-
активность ф. IX
-
ристоцетин кофакторная активность (активность фВ)
-
активность ф. XI
-
активность ф. ХII
Третий этап. Выполняется при выявленном снижении активности ф. VIII.
-
определение специфического ингибитора к ф.VIII.
-
определение неспецифического ингибитора (волчаночного антикоагулянта) выполняется при снижении активности нескольких факторов свёртывания крови, удлинении липид-зависимых тестов (АЧТВ с
чувствительными реактивами)
Диагноз и тяжесть гемофилии устанавливаются после выявления снижения активности факторов VIII или IX, и при отсутствии данных за приобретенное геморрагическое состояние, связанное с появлением ингибитора.
Контрольные коагулологические обследования.
Проводятся для уточнения формы заболевания, контроля развития осложнений и контроля эффективности фармакотерапии. Их режим описан выше.
-
Плановый контроль: АЧТВ, ПВ, ТВ, фибриноген, активность ф. VIII, ингибитор ф. VIII.Выполняется не реже 1 раза год.
-
При проведении индукции иммунной толерантности контроль эффективности фармакотерапии:активность ф.VIII, ингибитор ф. VIII, тест восстановления, построение фармакокинетической кривой
выполняется по протоколу ИИТ.
Дополнительные лабораторные обследования направлены на диагностику осложнений и сопутствующих состояний:
-
Биохимический анализ крови для оценки состояния печени выполняется 1 раз в год планово и при подозрении на развитие гепатита.
-
Биохимический анализ крови для оценки обмена железа показан при развитии анемии, детям первых трех лет жизни (не реже 1 раза в год), пациентам, страдающим повторными или массивными кровотечениями.
Инструментальная диагностика.
При наличии признаков поражения опорно-двигательного аппарата показана консультация ортопеда или травматолога. В дальнейшем проводится рентгенологическое исследование или МРТ пораженной области,
гониометрия, УЗИ суставов, забрюшинного пространства (при подозрении на забрюшинные гематомы), УЗИ мышц.
При подозрении на гематомы мягких тканей любой локализации, псевдоопухоли, кровотечения в полости организма необходимо проводить наиболее информативные методы лучевой диагностики. Решение о применении того или иного метода необходимо принимать после консультации со специалистами лучевой
диагностики, хирургами и травматологами.
Подозрение на кровотечение из органов желудочно-кишечного тракта требует выполнения ультразвукового обследования органов брюшной полости и почек, эндоскопических методов исследования.
При признаках гематурии необходимо УЗИ органов мочевыводящей системы и, возможно, дополнительное рентгеноконтрастное исследование, КТ или МРТ.
4.11.4 Требования к лекарственной помощи
Перечень лекарственных препаратов для оказания стационарной помощи приведен в таблице 8.
| Фармакотера певическая группа |
Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Эптаког альфа |
0,7 |
40,8 мг |
408 мг |
||
|
Ингибиторный |
0,7 |
6000 МЕ |
6000 МЕ |
||
|
Гидрокортизон |
0,200 |
50 мг |
150 мг |
||
|
Преднизолон |
0,070 |
120 мг |
1200 мг |
||
|
Эритромасса с удаленным |
0,020 |
500 мл |
500 мл |
||
|
Отмытые эритроциты |
0,020 |
500 мл |
500 мл |
||
|
Свежезамороженная |
0,010 |
500 мл |
500 мл |
||
|
Бетаметазон |
0,050 |
5 мг |
15 мг |
||
|
Железа сульфат |
0,200 |
100 мг |
500 мг |
||
|
Железа {III} гидроксид |
0,200 |
100 мг |
1500 мг |
||
|
Аминокапроновая кислота |
0,5 |
6000 мг |
42000 мг |
||
|
Транексамовая кислота |
0,5 |
1200 мг |
16800 |
||
|
Факторы свертывания |
Кровь и система кроветворения |
Фактор свертывания крови |
0,1 |
2000 МЕ |
316000 МЕ |
|
Факторы |
Кровь и система |
Фактор свертывания крови |
0,7 |
2000 МЕ |
3160000 МЕ |
Перечень лекарственных препаратов для амбулаторного ведения пациентов представлен в таблице 9.
| Фармакотера певическая группа | Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Эптаког альфа |
0,5 |
13,5 мг |
4927,5 мг |
||
|
Ингибиторный |
0,5 |
3000 МЕ |
547500 МЕ |
||
|
Железа сульфат |
0,200 |
100 мг |
1500 мг |
||
|
Транексамовая кислота |
0,5 |
1200 мг |
60000 мг |
||
|
Факторы свертывания |
Кровь и |
Фактор свертывания крови |
0,1 |
2000 МЕ |
316000 МЕ |
|
Факторы свертывания крови |
Кровь и система |
Фактор свертывания крови |
0,7 |
2000 МЕ |
3160000 МЕ |
Перечень лекарственных препаратов для курса индукции иммунной толерантности представлен в таблице 10.
| Фармакотера певическая группа | Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентирово чная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Факторы |
Кровь и |
Эптаког альфа |
0,5 |
13,5 мг |
4927,5 мг |
|
Факторы |
Кровь и |
Ингибиторный |
0,5 |
3000 МЕ |
547500 МЕ |
|
Фактор свертывания крови |
0,2 |
9000 МЕ |
3285000 МЕ |
||
|
Фактор свертывания крови |
0,8 |
9000 МЕ |
3285000 МЕ |
Приведенные в форме суточная и эквивалентная курсовая дозы препаратов являются ориентировочнойвеличиной. В каждом конкретном случае доза препаратов должна быть подобрана пациенту индивидуально с учетом массы тела, особенностей фармакокинетики и фармакодинамики у данного пациента.
4.11.5 Характеристики алгоритмов и особенностей применения медикаментов
4.11.5.1 Подбор препаратов.
При подборе препаратов шунтирующего действия необходимо ориентироваться на эффективность применения конкретного препарата у пациента.
При проведении индукции иммунной толерантности предпочтение надо отдавать препаратам фактора VIII, содержащим фВ. Однако, если возможно начать индукцию иммунной толерантности сразу после выявления ингибитора, ее необходимо проводить тем препаратом, который пациент получал к моменту диагностики ингибитора. Следует учесть, что после начала индукции иммунной толерантонсти смена препарата, которым она проводится недопустима.
4.11.5.2 Способы введения препаратов свертывания крови
Концентраты факторов свертывания крови и препараты шунтирующего действия вводятся внутривенно. Используется болюсная инфузия со скоростью, рекомендованной производителем.
4.11.5.3 Дозы и кратность введения при ингибиторной форме гемофилии А
Во всех случаях необходимо сразу использовать достаточную дозу и кратность введения препаратов. Использование неадекватно низкой дозы и кратности приводит к снижению эффективности, ухудшению состояния и увеличению расхода препаратов.
Неадекватно высокая доза может привести к развитию тромбозов и всегда неоправданно повышает расход.
Препараты факторов свертывания крови расфасованы дискретными дозами. Учитывая их высокую
стоимость после получения расчетной дозы необходимо вводить дозу, приближенную к результату расчета, КРАТНУЮ СОДЕРЖАНИЮ ПРЕПАРАТА В 1 ФЛАКОНЕ. Исключением может быть заместительная терапия у новорожденных и детей первых месяцев жизни.
Для пациентов с высокореагирующим ингибитором для профилактики и остановки кровотечений необходимо использовать только препараты шунтирующего действия: эптаког альфа и ингибиторный коагулянтный комплекс.
Расчет дозы эптакога альфа для остановки кровотечения:
-
90 – 120 мкг/кг каждые 2 – 4 часа,
-
270 мкг/кг разово, при необходимости возможно повторное введение через 6 – 8 часов.
Расчет дозы эптакога альфа для профилактического введения: 270 мкг/кг разово.
Расчет дозы ингибиторного коагулянтного комплекса для остановки кровотечения: 50 – 100 МЕ/кг разово.
Максимальная суточная доза – 200 МЕ/кг.
Расчет дозы ингибиторного коагулянтного комплекса для профилактического лечения: подбор дозы проводится индивидуально. Начальная схема: 100 МЕ/кг х 1 раз в сутки. При прекращении кровотечений, возможен перевод пациента на схему 100 МЕ/кг х 1 раз в 2 дня.
Пациентам с низкореагирующим ингибитором показано использование препаратов концентрата ф.VIII. Возможно профилактическое лечение: 100 МЕ/кг х 1 раз в 2 дня. Если использование такой схемы неэффективно, показано применение концентрата ф. VIII по требованию: при травмах, кровотечениях и
кровоизлияниях, краткосрочная профилактика перед инвазивными манипуляциями. Рекомендации по подбору дозы даны выше.
При недостаточной эффективности, пациентам с низкореагирующим ингибитором показано применение
препаратов шунтирующего действия в стандартных дозах и по стандартным схемам.
При проведении индукции иммунной толерантности пациентам с высокореагирующим ингибитором в начале лечения показано введение препаратов болюсно по схеме: 150 МЕ/кг х каждые 12 часов. Пациентам с низкореагирующим ингибитором рекомендована начальная схема: 100 МЕ/кг х 1 раз в 2 дня.
Подробные рекомендации по длительности, порядку контроля и снижения дозы концентрата ф.VIII даны в разделе, посвященном ингибиторной гемофилии А.
4.11.5.4 Лабораторный контроль терапии
Общепринятых технологий лабораторного контроля терапии препаратами шунтирующего действия нет. Контроль индукции иммунной толерантности проводится путем определения титра ингибитора, а после снижения титра ингибитора менее2 БЕ, выполняют тест восстановления и построение фармакокинетической
кривой для определения периода полувыведения.
4.11.6 Требования к режиму труда, отдыха, лечения или реабилитации
Ограничения в соответствии с текущим статусом пациента.
4.11.7 Требования к уходу за пациентом и вспомогательным процедурам
Соблюдение пациентами правил личной гигиены. Требования в соответствии с текущим статусом.
4.11.8 Требования к диетическим назначениям и ограничениям
При наличии аллергоанамнеза исключать причинно-значимые продукты.
При кровотечениях из ран слизистой рта показан протертый стол.
При кровотечениях из желудочно-кишечного тракта показана диета, соответствующая установленному гастроэнтерологическому диагнозу.
4.11.9 Особенности информированного добровольного согласия пациента при выполнении протокола ведения больных и дополнительная информация для пациента и членов его семьи
Информированное добровольное согласие пациент (опекун пациента) дает в письменном виде.
Пациенту (опекуну) следует объяснить необходимость и правила режима, диеты, необходимость фармакологической интервенции.
4.11.10 Правила изменения требований при выполнении протокола и прекращение действия требований протокола
Протокол перестает действовать при устойчивой элиминации ингибитора ф.VIII. + Дальнейшая медицинская помощь пациенту оказывается в соответствии с требованиями соответствующего протокола.
4.11.11 Возможные исходы и их характеристика
Возможные исходы ингибиторной гемофилии А и их характеристика представлены в таблице 11.
| Наименование исхода |
Частота развития, % |
Критерии и признаки | Ориентировочное время достижения исхода, лет |
Преемственность и этапность оказания медицинской помощи |
|---|---|---|---|---|
|
Летальный исход |
Менее 0,1% |
Наступление смерти |
– |
|
|
Элиминация |
60% |
Отсутствие клинических и лабораторных |
Через 3 года после |
|
|
Развитие |
30% |
Рентгенологические |
10 – 12 лет |
4.12 Модель пациента 3. Гемофилия В.
| Обязательная составляющая модели | Описание составляющей |
|---|---|
|
Нозологическая форма |
Гемофилия В |
|
Стадия заболевания |
Нет |
|
Фаза заболевания |
Нет |
|
Осложнения |
Система органов кроветворения и кровь: анемия, |
|
Код по МКБ-10 |
D67 |
4.12.1 Критерии и признаки, определяющие модель пациента
Данные семейного анамнеза: примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по женской линии (у мужчин, реже у женщин).
Данные личного анамнеза: геморрагические проявления. В том числе кожный гемосиндром, гематомы мягких тканей, отсроченные кровотечения, длительные посттравматические кровотечения, кровоизлияния в суставы и их маски.
Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и (или) множественные гематомы, системность геморрагических проявлений
(проявления различной локализации), «спонтанные геморрагические проявления», возникающие из-за длительного латентного периода и несоответствия тяжести проявления тяжести травмы. При лабораторном обследовании выявляется снижение активности фактора IX менее 50%.
4.12.2 Перечень медицинских услуг основного и дополнительного ассортимента
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для диагностики лечении в стационаре представлен в таблице 12.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A03.16.001 |
Эзофагогастродуоденоскопия |
0,050 |
1,000 |
|
A03.18.001 |
Толстокишечная эндоскопия |
0,050 |
1,000 |
|
A03.19.002 |
Ректороманоскопия |
0,050 |
1,000 |
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,050 |
2,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,80 |
2,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,800 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,050 |
2,000 |
|
A05.04.001 |
Магнитно- резонансная томография суставов (один |
0,050 |
1,000 |
|
A05.10.002 |
Проведение электрокардиографических |
0,050 |
1,000 |
|
A05.14.001 |
Магнитно-резонансная томография органов брюшной |
0,050 |
1,000 |
|
A05.23.001 |
Электроэнцефалография |
0,10 |
1,000 |
|
A05.23.009 |
Магнитно-резонансная томография головного мозга |
0,10 |
1,0 |
|
A05.30.007 |
Магнитно-резонансная томография забрюшиного |
0,010 |
1,000 |
|
A05.30.008 |
Магнитно-резонансная томография шеи |
0,05 |
1,000 |
|
A06.03.002.003 |
Спиральная компьютерная томография головы |
0,050 |
1,000 |
|
A06.03.028 |
Рентгенография плечевой кости |
0,050 |
1,000 |
|
A06.03.029 |
Рентгенография локтевой кости и лучевой кости |
0,050 |
1,000 |
|
A06.03.032 |
Рентгенография кисти руки |
0,050 |
1,000 |
|
A06.03.043 |
Рентгенография бедренной кости |
0,050 |
1,000 |
|
A06.03.046 |
Рентгенография большой берцовой и малой берцовой |
0,050 |
1,000 |
|
A06.03.053 |
Рентгенография стопы в двух проекциях |
0,050 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,050 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,050 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,050 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,050 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,050 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,050 |
1,000 |
|
A06.28.002 |
Внутривенная урография |
0,01 |
1,000 |
|
A06.30.007 |
Компьютерная томография забрюшинного |
0,05 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,500 |
1,000 |
|
A09.05.049 |
Исследование уровня факторов свертывания в крови |
0,7 |
1 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,70 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,50 |
1,000 |
|
A09.05.187 |
Определение активности фактора IX в сыворотке |
0,10 |
1,000 |
|
A09.05.187 |
Определение активности фактора IX в сыворотке |
0,2 |
12 |
|
A09.05.188 |
Определение активности фактора VIII в сыворотке |
0,10 |
1,000 |
|
A09.28.001 |
Микроскопическое исследование осадка мочи |
0,20 |
1,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,7 |
2 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,3 |
12 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,2 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,2 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,20 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,50 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,050 |
1,000 |
|
A12.05.016 |
Исследование свойств сгустка крови |
0,050 |
2,000 |
|
A12.05.017 И |
сследование агрегации тромбоцитов |
0,050 |
3,000 |
|
A12.05.027 |
Определение протромбинового (тромбопластинового) |
0,5 |
1,0 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,5 |
1,0 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,3 |
1,000 |
|
A12.05.050 |
Определение активности ингибиторов к фактору IX в |
0,05 |
1 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,050 |
1,000 |
|
A26.06.040 |
Определение антител классов M, G (IgM, IgG) к |
0,500 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
0,5 |
1,000 |
|
A26.06.043 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,500 |
1,000 |
|
A26.06.044 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,500 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к вирусу |
0,5 |
1,000 |
|
B01.003.001 |
Осмотр (консультация) врачом-анестезиологом- |
0,050 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
1,0 |
1,000 |
|
B01.005.003 |
Ежедневный осмотр врачом-гематологом с |
1,0 |
15,000 |
|
B01.010.001 |
Прием (осмотр, консультация) врача-детского хирурга |
0,050 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,30 |
1,000 |
|
B01.023.001 |
Прием (осмотр, консультация) врача- невролога |
0,050 |
1,000 |
|
B01.028.001 |
Прием (осмотр, консультация) врача- |
0,050 |
1,000 |
|
B01.031.001 |
Прием (осмотр, консультация) врача-педиатра |
0,3 |
1,000 |
|
B01.047.007 |
Прием (осмотр, консультация) врача приемного |
1,0 |
1,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – травматолога- |
0,3 |
1,000 |
|
B01.053.001 |
Прием (осмотр, консультация) врача-уролога |
0,050 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,30 |
2,000 |
|
B01.067.001 |
Прием (осмотр, консультация) врача-стоматолога- |
0,10 |
1,000 |
|
B03.005.006 |
Коагулограмма (ориентировочное исследование |
0,5 |
1 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,0 |
2,000 |
|
B03.016.004 |
Анализ крови биохимический общетерапевтический |
1,0 |
1,0 |
|
B03.016.006 |
Анализ мочи общий |
1,0 |
2 |
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для оказания специализированной амбулаторной помощи представлен в таблице 13.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A04.01.001 |
Ультразвуковое исследование мягких тканей |
0,100 |
2,000 |
|
A04.04.001 |
Ультразвуковое исследование сустава |
0,050 |
1,000 |
|
A04.16.001 |
Ультразвуковое исследование органов брюшной |
0,5 |
1,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,500 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,010 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,10 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,10 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,100 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,010 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,100 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,100 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,2 |
1,000 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,300 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,200 |
1,000 |
|
A09.05.187 |
Определение активности фактора IX в сыворотке |
0,050 |
1,000 |
|
A11.05.001 |
Взятие крови из пальца |
1,000 |
1,000 |
|
A11.12.003 |
Внутривенное введение лекарственных |
0,100 |
160,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
1,000 |
4,000 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,050 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,050 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,050 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей способности |
0,200 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,010 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,300 |
4,000 |
|
A12.05.027 |
Определение протромбинового |
0,500 |
1,000 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,500 |
1,000 |
|
A12.05.035 |
Исследование активности и свойств фактора |
0,200 |
1,000 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, |
0,500 |
1,000 |
|
A12.05.050 |
Определение активности ингибиторов к фактору |
0,2 |
1 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,300 |
1,000 |
|
A13.29.003 |
Психологическая адаптация |
0,100 |
1,000 |
|
A13.29.007 |
Психологическая коррекция |
0,100 |
1,000 |
|
A13.29.011 |
Социально-реабилитационная работа |
0,500 |
1,000 |
|
A14.12.001 |
Уход за сосудистым катетером |
0,010 |
160,000 |
|
A19.04.001 |
Лечебная физкультура при заболеваниях и |
0,100 |
90,000 |
|
A19.05.001 |
Лечебная физкультура при заболеваниях системы |
0,900 |
120,000 |
|
A20.30.001 |
Ванны минеральные |
0,300 |
10,000 |
|
A20.30.012 |
Воздействие климатом |
0,500 |
21,000 |
|
A24.01.002 |
Наложение компресса на кожу |
0,100 |
160,000 |
|
A26.06.034 |
Определение антител классов M, G (IgG, IgM) к |
1,000 |
1,000 |
|
A26.06.036 |
Определение антигена к вирусу гепатита В |
1,000 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) к |
1,000 |
1,000 |
|
A26.06.063 |
Определение антител классов M, G (IgM, IgG) к |
0,500 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
1,000 |
|
B01.005.002 |
Прием (осмотр, консультация) врача-гематолога |
1,000 |
11,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,800 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по лечебной |
0,500 |
2,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – |
0,800 |
1,000 |
|
B01.050.002 |
Прием (осмотр, консультация) врача – |
0,300 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,500 |
2,000 |
|
B01.064.003 |
Прием (осмотр, консультация) врача- стоматолога |
0,800 |
1,000 |
|
B01.064.004 |
Прием (осмотр, консультация) врача-стоматолога |
0,500 |
2,000 |
|
B02.069.001 |
Прием (тестирование, консультация) медицинского психолога первичный |
0,500 |
1,000 |
|
B02.069.002 |
Прием (тестирование, консультация) |
0,200 |
3,000 |
|
B03.016.003 |
Общий (клинический) анализ крови развернутый |
1,000 |
1,000 |
|
B03.016.004 |
Анализ крови биохимический |
0,100 |
1,000 |
|
B03.016.006 |
Анализ мочи общий |
0,100 |
1,000 |
|
B04.020.001 |
Диспансерный прием (осмотр, консультация) |
0,200 |
2,000 |
|
B04.020.002 |
Профилактический прием (осмотр, консультация) |
0,100 |
2,000 |
|
B04.069.001 |
Школа психологической профилактики для |
0,900 |
2,000 |
4.12.3 Характеристика алгоритмов и особенностей применения медицинских услуг при данной модели пациента
Физикальное обследование
Направлено на выявление геморрагических симптомов и дает основания для проведения дополнительных обследований: УЗДГ, КТ, рентгенографии, МРТ. Кроме того, позволяет заподозрить такие осложнения, как анемия, поражение печени, поражение опорно-двигательного аппарата.
Лабораторная диагностика
Первичная лабораторная диагностика проводится этапно:
Первый этап. Коагулологический скрининг при подозрении на геморрагические состояния:
-
активированное парциальное (частичное) тромбопластиновое время (АЧТВ, АПТВ)
-
протромбиновое время (ПВ)
-
тромбиновое время (ТВ)
-
количество фибриногена (по Клаусу)
-
время кровотечения стандартизованным методом (например, по Айви) или инструментальная оценка функции тромбоцитов
Второй этап. Выполняется при изолированном удлинении АЧТВ, либо при отсутствии изменения в скрининге и наличии клинических признаков лёгкой формы гемофилии.
-
тест коррекции (коррекция АЧТВ при смешивании плазмы пациента с нормальной плазмой)
-
активность ф VIII
-
активность ф. IX
-
ристоцетин кофакторная активность (активность фВ)
-
активность ф. XI
-
активность ф. ХII
Третий этап. Выполняется при выявленном снижении активности ф. IX.
-
определение специфического ингибитора к ф.IX.
-
определение неспецифического ингибитора (волчаночного антикоагулянта) выполняется при снижении активности нескольких факторов свёртывания крови, удлинении липид-зависимых тестов (АЧТВ с чувствительными реактивами)
Диагноз и тяжесть гемофилии устанавливаются после выявления снижения активности фактора IX, и при отсутствии данных за приобретенное геморрагическое состояние, связанное с появлением ингибитора.
Контрольные коагулологические обследования.
Проводятся для уточнения формы заболевания, контроля развития осложнений и контроля эффективности фармакотерапии. Их режим описан выше.
-
Плановый контроль: АЧТВ, ПВ, ТВ, фибриноген, активность ф. IX, ингибитор ф. IX. Выполняется
не реже 1 раза в 3 года. -
Контроль ингибитора: АЧТВ, ПВ, ТВ, фибриноген, активность ф. IX, ингибитор ф. IX. Выполняется:
-
Пациентам с тяжелой и среднетяжелой гемофилией B каждые 5 – 10 дней введения
концентрата ф. IX на протяжении первых 20 – 50 дней введения. -
Пациентам не зависимо от тяжести гемофилии перед плановым хирургическим лечением.
-
При появлении клинических или лабораторных данных за развитие ингибитора.
-
-
Контроль эффективности фармакотерапии: активность ф.IX, ингибитор ф. IX (если не выполнялся ранее или есть подозрение на его развитие), тест восстановления, построение фармакокинетической кривой. Выполняется при недостаточной эффективности адекватных доз препарата, для подбора
оптимальной схемы профилактической заместительной терапии.
Дополнительные лабораторные обследования направлены на диагностику осложнений и сопутствующих состояний:
-
Биохимический анализ крови для оценки состояния печени выполняется 1 раз в год планово и при подозрении на развитие гепатита.
-
Биохимический анализ крови для оценки обмена железа показан при развитии анемии, детям первых трех лет жизни (не реже 1 раза в год), пациентам, страдающим повторными или массивными кровотечениями.
Инструментальная диагностика.
При наличии признаков поражения опорно-двигательного аппарата показана консультация ортопеда или травматолога. В дальнейшем проводится рентгенологическое исследование или МРТ пораженной области,
гониометрия, УЗИ суставов, забрюшинного пространства (при подозрении на забрюшинные гематомы), УЗИ мышц.
При подозрении на гематомы мягких тканей любой локализации, псевдоопухоли, кровотечения в полости организма необходимо проводить наиболее информативные методы лучевой диагностики. Решение о применении того или иного метода необходимо принимать после консультации со специалистами лучевой
диагностики, хирургами и травматологами.
Подозрение на кровотечение из органов желудочно-кишечного тракта требует выполнения ультразвукового обследования органов брюшной полости и почек, эндоскопических методов исследования.
При признаках гематурии необходимо УЗИ органов мочевыводящей системы и, возможно, дополнительное рентгеноконтрастное исследование, КТ или МРТ.
4.12.4 Требования к лекарственной помощи
Требования к лекарственной помощи в стационаре представлены в таблице 14.
| Фармакотера певическая группа |
Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентирово чная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Факторы свертывания |
Кровь и |
Фактор свертывания крови |
0,1 |
6000 МЕ |
120000 МЕ |
|
Гидрокортизон |
0,01 |
50 мг |
150 мг |
||
|
Преднизолон |
0,01 |
120 мг |
1200 мг |
||
|
Эритромасса с удаленным |
0,010 |
500 мл |
500 мл |
||
|
Отмытые эритроциты |
0,010 |
500 мл |
500 мл |
||
|
Свежезамороженная |
0,010 |
500 мл |
500 мл |
||
|
Бетаметазон |
0,010 |
5 мг |
15 мг |
||
|
Железа сульфат |
0,02 |
100 мг |
1500 мг |
||
|
Железа {III} гидроксид |
0,02 |
100 мг |
1500 мг |
||
|
Аминокапроновая кислота |
0,05 |
6000 мг |
42000 мг |
||
|
Транексамовая кислота |
0,05 |
1200 мг |
16800 |
||
|
Эптаког альфа |
0,01 |
13,5 мг |
4927,5 мг |
Перечень лекарственных препаратов для амбулаторного ведения пациентов представлен в таблице 15.
| Фармакотера певическая группа |
Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Факторы |
Кровь и |
Фактор свертывания крови |
0,7 |
3000 МЕ |
315000 МЕ |
|
Фактор свертывания крови |
0,3 |
3000 МЕ |
36000 МЕ |
||
|
Железа сульфат |
0,05 |
100 мг |
1500 мг |
||
|
Транексамовая кислота |
0,3 |
1200 мг |
60000 мг |
||
|
Факторы |
Кровь и |
Эптаког альфа |
0,1 |
13,5 мг |
4927,5 мг |
Приведенные в форме дозы препаратов являются ориентировочной величиной. В каждом конкретном случае доза препаратов должна быть подобрана пациенту индивидуально. Эквивалентная курсовая доза – рассчитана для 10 введений препарата; длительность курса должна быть подобрана индивидуально.
4.12.5 Характеристики алгоритмов и особенностей применения медикаментов
Способы введения препаратов свертывания крови
Концентраты факторов свертывания крови вводятся внутривенно. Чаще всего используется болюсная инфузия со скоростью, рекомендованной производителем.
Поскольку разведенный препарат может долго сохранять активность в растворе, возможно применение непрерывной болюсной инфузии. Последнее позволяет снизить расход и избежать значимых колебаний активности в крови. Применение непрерывной инфузии показано пациентам, перенесшим большие операции или проходящим лечение по поводу тяжелых травм, соблюдающим постельный режим.
Дозы и кратность введения при неосложненной гемофилии
Во всех случаях необходимо сразу использовать достаточную дозу и кратность введения препаратов. Использование неадекватно низкой дозы и кратности приводит к снижению эффективности, ухудшению состояния и увеличению расхода препаратов.
Неадекватно высокая доза может привести к развитию тромбозов и всегда неоправданно повышает расход.
Препараты факторов свертывания крови расфасованы дискретными дозами. Учитывая их высокую стоимость после получения расчетной дозы необходимо вводить дозу, приближенную к результату расчета, КРАТНУЮ СОДЕРЖАНИЮ ПРЕПАРАТА В 1 ФЛАКОНЕ. Исключением может быть заместительная терапия у новорожденных и детей первых месяцев жизни.
Расчет дозы концентратов фактора IX проводиться исходя из целевого значения активности дефицитного фактора при тех или иных состояниях и периода полувыведения препарата.
Имеющиеся индивидуальные колебания фармакокинетических параметров у каждого пациента требуют индивидуальной оценки фармакокинетической кривой. В случае, если у пациента такой анализ проведен,
расчет дозы и кратности введения должен проводиться с учетом имеющихся данных.
Необходимо учитывать, что у пациентов с продолжающейся кровопотерей, с тяжелой травмой или перенесших большое оперативное вмешательство период полувыведения препарата, как правило, укорачивается.
При отсутствии данных об индивидуальных особенностях фармакокинетики, возможно использование усредненных значений, приведенных ниже.
Период полувыведения фактора IX составляет около 24 часов.
При введении 1 МЕ/кг массы тела пациента активность фактора IX повышается, в среднем на 1% (тест восстановления = 1).
Расчет дозы концентрата фактора IX:
Доза (МЕ) = масса тела х (требуемая активность — базальная активность).
Рекомендации по клиническому и лабораторному контроля приведены выше.
Рекомендации по требуемому уровню активности факторов и длительности терапии при неосложненной гемофилии приведены в таблице 17. Данная информация является ориентировочной. После остановки первичного кровотечения должна проводиться профилактика с целью предотвращения рецидивов и неосложненного восстановления. Решение о прекращении заместительной терапии должно приниматься с
учетом имеющихся рекомендаций. Терапию можно прекратить после завершения процесса рубцевания, рассасывания гематомы и восстановления функции.
В настоящее время нет данных о преимуществе той или иной группы препаратов концентрата ф.IX над другими. Детям должны назначаться только препараты, эффективность и безопасность которых у детей доказаны в клинических исследованиях.
При амбулаторном ведении, около 70% пациентов с гемофилией А показана постоянная профилактическая заместительная терапия. Рекомендации по дозированию препаратов приведены выше. В таблице указаны средние профилактические дозы на пациента массой тела 50 кг и разовой дозой 40 МЕ/кг.
Около 30% пациентов получают лечение по требованию. Это пациенты с легкой и среднетяжелой гемофилией А, которые не страдают рецидивирующими кровоизлияниями в элементы опорно-двигательного аппарата.
4.12.5.1 Лабораторный контроль терапии
Лабораторный контроль у пациентов, получающих терапию по поводу кровотечения или кровоизлияния заключается в анализе остаточной активности фактора перед следующим введением, анализа наличия ингибитора.
4.12.6 Требования к режиму труда, отдыха, лечения или реабилитации
Ограничения в соответствии с текущим статусом пациента
4.12.7 Требования к уходу за пациентом и вспомогательным процедурам
Соблюдение пациентами правил личной гигиены. Требования в соответствии с текущим статусом.
4.12.8 Требования к диетическим назначениям и ограничениям
При наличии аллергоанамнеза исключать причинно-значимые продукты.
При кровотечениях из ран слизистой рта показан протертый стол.
При кровотечениях из желудочно-кишечного тракта показана диета, соответствующая установленному гастроэнтерологическому диагнозу.
4.12.9 Особенности информированного добровольного согласия пациента при выполнении протокола ведения больных и дополнительная информация для пациента и членов его семьи
Информированное добровольное согласие пациент (опекун пациента) дает в письменном виде.
Пациенту (опекуну) следует объяснить необходимость и правила режима, диеты, необходимость фармакологической интервенции.
4.12.10 Правила изменения требований при выполнении протокола и прекращение действия требований протокола
Протокол перестает действовать при выявлении ингибитора ф.IX. При развитии ингибитора медицинская помощь пациенту оказывается в соответствии с требованиями соответствующего протокола.
4.12.11 Возможные исходы и их характеристика
Возможные исходы гемофилии В и их характеристика представлены в таблице 16.
| Наименование исхода | Частота развития, % |
Критерии и признаки | Ориентировочное время достижения исхода, лет |
Преемственность и этапность оказания медицинской помощи |
|---|---|---|---|---|
|
Летальный исход |
Менее 0,1% |
Наступление смерти |
– |
|
|
Развитие |
5% |
Рентгенологические |
14 – 16 лет |
4.13 Модель пациента 3. Болезнь Виллебранда
| Обязательная составляющая модели | Описание составляющей |
|---|---|
|
Нозологическая форма |
Болезнь Виллебранда |
|
Стадия заболевания |
Нет |
|
Фаза заболевания |
Нет |
|
Осложнения |
Система органов кроветворения и кровь: анемия, |
|
Код по МКБ-10 |
D68.0 |
4.13.1 Критерии и признаки, определяющие модель пациента
Болезнь Виллебранда (бВ) — геморрагическое заболевание, возникающее вследствие генетически обусловленного качественного или количественного нарушения фактора Виллебранда. Ожидаемая распространенность клинически значимых форм бВ составляет приблизительно 1 — 2 на 10.000 человек.
Семейный анамнез может содержать данные о геморрагическом состоянии, наследуемом по аутосомному типу. Отсутствие данных за геморрагическое заболевание в семейном анамнезе не позволяет исключить бВ. Большинство форм бВ наследуется аутосомно доминантно с неполной пенетрантностью. 3 тип бВ — аутосомно рецессивно.
Для большинства форм бВ характерна геморрагические проявления по микроциркуляторному, смешанному (микроциркуляторному и гематомному) или гематомному типам кровоточивости.
-
Микроциркуляторный гемосиндром характерен для 1, 2А, 2В, 2M типов бВ. Типичными являются экхимозы, кровотечения из травмированных слизистых оболочек, длительные кровотечения из лунок удаленных или выпавших зубов, которые могут быть опасными для жизни, носовые кровотечения, маточные кровотечения у девушек, интра- и послеоперационные кровотечения. В более старшем возрасте — желудочно-
кишечные кровотечения и кровотечения из мочевых путей. Менее характерны кровотечения из мест инъекций и гематомы мягких тканей после различных травм.Сроки возникновения первых проявлений разнообразны и зависят от тяжести заболевания и от целого ряда
непредвиденных обстоятельств: травмы, необходимость оперативного лечения, прием дезагрегантов,
провоцирующих кровотечения, сопутствующие заболевания, однако геморрагические проявления в первые
несколько месяцев жизни не характерны. -
Смешанный (гематомный + микроциркуляторный) гемосиндром характерен для больных 3 типом бВ и тяжелыми формами 1, 2А типа. Клиническое течение напоминает гемофилию, однако заболевание у пациентов с бВ протекает тяжелее, чем у пациентов с гемофилией А и аналогичным уровнем фVШ. При бВ,
в отличие от гемофилии, кровотечение начинается сразу после травмы и не останавливается.Первые проявления могут отмечаться в периоде новорожденности — кожный гемосиндром, гематомы и кровотечения из мест инъекций. На первом году жизни характерно нарастание кожного гемосиндрома, появляются гематомы мягких тканей. Наиболее опасны для жизни кровотечения при травмах слизистой
оболочки полости рта. Прорезывание зубов может не сопровождаться кровотечениями, но, позже, при смене зубов, кровотечения из десен в области баллотирующего зуба и из лунок выпавших зубов бывают очень часто. Кровоизлияния в суставы, так же, как и при гемофилии, могут начаться на первом году жизни.После года, по мере нарастания двигательной активности, выраженность гемосиндрома у детей увеличивается. Характерны интра- и послеоперационные кровотечения, кровотечения из ран кожи и слизистых, носовые кровотечения, а в более старшем возрасте — кишечные кровотечения и кровотечения из
мочевых путей.Маточные кровотечения у девочек с бВ являются серьезной проблемой. Носовые кровотечения, кровотечения после травм слизистых оболочек, особенно полости рта, послеоперационные кровотечения могут привести к тяжелой постгеморрагической анемии и при отсутствии лечения — к гибели пациента.
Кишечные кровотечения редкость у детей младшего возраста, более характерны для детей, начиная со средней школы.
-
Гематомный тип кровоточивости. Клиническая картина сходна с клиникой нетяжёлой гемофилии и редко сопровождается поражением суставов. Характерны отсроченные кровотечения при травмах и после операций. Могут возникать посттравматические гематомы мягких тканей.
Недавно описано проявление болезни Виллебранда в виде формирования грубых выступающих рубцов после травм. Такое проявление может быть даже у пациентов не имеющих значимого геморрагического синдрома.
Классификация
Выделяют 3 типа бВ.
Тип 1 — составляет около 70% всех случаев. Происходит различной степени выраженности количественное снижение фВ. ФVШ может быть снижен или нормальный, пропорционально степени снижения активности фВ.
Тип 2 — качественные дефекты фВ. Разделяется на 4 подтипа:
-
2А — отсутствие в крови тяжёлых или тяжёлых и средних мультимеров фВ. ФУШ может быть
нормальный или сниженный. -
2В — патологическое повышение аффинности фВ к тромбоцитарным рецепторам, при которых происходит связывание неактивированного фВ с интактными тромбоцитами, и активная элиминация из крови наиболее высокомолекулярного фВ и части тромбоцитов. Характерна легкая или умеренная тромбоцитопения, снижение активности фВ, повышение степени агрегации тромбоцитов с ристомицином
(ристоцетином или аггристином) при разведении реактива до концентрации менее 0,8 мг/мл. ФVIII, как правило, нормальный. -
2М — точечный дефект, обуславливающий снижение ристомицин кофакторной активности без
количественного снижения белка (фВ). ФVIII, как правило, нормальный. -
2N — изолированное нарушение связывания фVIII, приводящее к преждевременной его инактивации и разной степени выраженности снижению активности в крови. Функция адгезии тромбоцитов не нарушается.
Тип 3. При этом типе в крови отсутствует белок, идентифицируемый, как фВ. Отмечается низкая активность фVIII.
Сейчас описаны ещё несколько форм бВ:
Форма Виченза, при которой в крови постоянно находятся сверхтяжелые мультимеры фВ и снижено общее количество и активность (сейчас эту форму относят к типу 1). Описаны случаи изолированного нарушения
коллаген связывающей функции фВ.
Общепризнанной классификации бВ по тяжести не существует.
Критерии диагноза:
-
Геморрагические проявления (склонность к образованию грубых рубцов).
-
Снижение специфической активности фВ.
4.13.2 Перечень медицинских услуг основного и дополнительного ассортимента
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для диагностики и лечения в стационаре представлен в таблице 17.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A03.16.001 |
Эзофагогастродуоденоскопия |
0,050 |
1,000 |
|
A03.18.001 |
Толстокишечная эндоскопия |
0,050 |
1,000 |
|
A03.19.002 |
Ректороманоскопия |
0,050 |
1,000 |
|
A04.04.001 |
Ультразвуковое исследование сустава |
0,050 |
2,000 |
|
A04.16.001 |
Ультразвуковое исследование органов |
0,900 |
1,000 |
|
A04.20.001 |
Ультразвуковое исследование матки и |
0,100 |
1,000 |
|
A04.28.002 |
Ультразвуковое исследование мочевыводящих |
0,90 |
1,000 |
|
A04.30.003 |
Ультразвуковое исследование забрюшинного |
0,010 |
1,000 |
|
A05.04.001 |
Магнитно- резонансная томография суставов |
0,050 |
2,000 |
|
A05.23.009 |
Магнитно-резонансная томография головного |
0,050 |
0,500 |
|
A05.30.004 |
Магнитно-резонансная томография органов |
0,010 |
1,000 |
|
A06.03.002.003 |
Спиральная компьютерная томография головы |
0,010 |
1,000 |
|
A06.03.005 |
Рентгенография всего черепа, в одной или |
0,050 |
1,000 |
|
A06.03.028 |
Рентгенография плечевой кости |
0,010 |
1,000 |
|
A06.03.029 |
Рентгенография локтевой кости и лучевой |
0,010 |
1,000 |
|
A06.03.032 |
Рентгенография кисти руки |
0,010 |
1,000 |
|
A06.03.043 |
Рентгенография бедренной кости |
0,010 |
1,000 |
|
A06.03.046 |
Рентгенография большой берцовой и малой |
0,010 |
1,000 |
|
A06.03.053 |
Рентгенография стопы в двух проекциях |
0,010 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,010 |
1,000 |
|
A06.04.004 |
Рентгенография лучезапястного сустава |
0,010 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,010 |
1,000 |
|
A06.04.010 |
Рентгенография плечевого сустава |
0,010 |
1,000 |
|
A06.04.011 |
Рентгенография бедренного сустава |
0,010 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,010 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,010 |
1,000 |
|
A06.30.007 |
Компьютерная томография забрюшинного |
0,010 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,900 |
1,000 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,5 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,5 |
1,000 |
|
A09.05.187 |
Определение активности фактора IX в |
0,100 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в |
0,100 |
1,000 |
|
A09.05.220 |
Исследование уровня антигена фактора |
0,5 |
1,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
1 |
2,0 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,5 |
1,0 |
|
A12.05.006 |
Определение резус-принадлежности |
0,500 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,500 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей |
0,5 |
1,000 |
|
A12.05.015 |
Исследование времени кровотечения |
0,500 |
1,000 |
|
A12.05.016 |
Исследование свойств сгустка крови |
0,100 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,100 |
3,000 |
|
A12.05.027 |
Определение протромбинового |
0,5 |
1,000 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,5 |
1,0 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,5 |
1,000 |
|
A12.05.035 |
Исследование активности и свойств фактора |
0,5 |
1,000 |
|
A12.05.035.001 |
Определение фактора Виллебранда в |
0,05 |
1,0 |
|
A12.05.035.002 |
Анализ мультимеров фактора Виллебранда в |
0,050 |
1,000 |
|
A12.05.035.003 |
Коллагенсвязывающий тест |
0,5 |
1,0 |
|
A12.05.035.004 |
Специфический тест способности фактора |
0,010 |
1,000 |
|
A12.05.039 |
Определение времени свертывания плазмы |
0,300 |
1,000 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,300 |
1,000 |
|
A26.06.034 |
Определение антител классов M, G (IgG, IgM) |
0,5 |
1,000 |
|
A26.06.036 |
Определение антигена к вирусу гепатита В |
0,5 |
1,000 |
|
A26.06.040 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.043 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.044 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.063 |
Определение антител классов M, G (IgM, IgG) |
0,5 |
1,000 |
|
A26.06.082 |
Определение антител к бледной трепонеме |
0,1 |
1,000 |
|
B01.001.001 |
Прием (осмотр, консультация) врача-акушера- |
0,200 1, |
000 |
|
B01.003.001 |
Осмотр (консультация) врачом-анестезиологом-реаниматологом первичный |
0,050 |
1,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача- |
1,000 |
1,000 |
|
B01.005.003 |
Ежедневный осмотр врачом-гематологом с |
1,000 |
15,000 |
|
B01.010.001 |
Прием (осмотр, консультация) врача-детского |
0,100 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по |
0,100 |
1,000 |
|
B01.023.001 |
Прием (осмотр, консультация) врача- |
0,010 |
1,000 |
|
B01.024.001 |
Прием (осмотр, консультация) врача- |
0,010 |
1,000 |
|
B01.028.001 |
Прием (осмотр, консультация) врача- |
0,400 |
1,000 |
|
B01.029.001 |
Прием (осмотр, консультация) врача- |
0,010 |
1,000 |
|
B01.031.001 |
Прием (осмотр, консультация) врача-педиатра |
0,5 |
1,000 |
|
B01.047.007 |
Прием (осмотр, консультация) врача |
1,000 |
1,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – |
0,100 |
1,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,700 |
2,000 |
|
B01.067.001 |
Прием (осмотр, консультация) врача- |
0,10 |
1,000 |
|
B03.005.006 |
Коагулограмма (ориентировочное |
0,5 |
1,0 |
|
B03.016.003 |
Общий (клинический) анализ крови |
1,000 |
2,000 |
|
B03.016.004 |
Анализ крови биохимический |
1,000 |
1,000 |
|
B03.016.006 |
Анализ мочи общий |
1,000 |
1,000 |
|
A09.05.188 |
Определение активности фактора VIII в |
0,100 |
6,000 |
|
A09.05.220 |
Исследование уровня антигена фактора |
0,1 |
6,000 |
|
A12.05.035.003 |
Коллагенсвязывающий тест |
0,1 |
6,0 |
Перечень медицинских услуг (МУ) согласно «Номенклатуре услуг в здравоохранении» для диагностики и лечения амбулаторно представлен в таблице 18.
| Код МУ | Наименование МУ | Частота предоставления |
Кратность выполнения |
|---|---|---|---|
|
A04.16.001 |
Ультразвуковое исследование органов |
0,100 |
1,000 |
|
A04.20.001 |
Ультразвуковое исследование матки и |
0,100 |
1,000 |
|
A06.04.003 |
Рентгенография локтевого сустава |
0,030 |
1,000 |
|
A06.04.005 |
Рентгенография коленного сустава |
0,050 |
1,000 |
|
A06.04.012 |
Рентгенография голеностопного сустава |
0,050 |
1,000 |
|
A06.04.017.001 |
Спиральная компьютерная томография сустава |
0,050 |
1,000 |
|
A09.05.007 |
Исследование уровня железа сыворотки крови |
0,500 |
0,700 |
|
A09.05.050 |
Исследование уровня фибриногена в крови |
0,050 |
1,000 |
|
A09.05.076 |
Исследование уровня ферритина в крови |
0,500 |
0,700 |
|
A09.05.188 |
Определение активности фактора VIII в |
0,250 |
11,000 |
|
A09.05.220 |
Исследование уровня антигена фактора |
0,300 |
0,700 |
|
A11.05.001 |
Взятие крови из пальца |
0,900 |
2,000 |
|
A11.12.003 |
Внутривенное введение лекарственных |
0,050 |
130,000 |
|
A11.12.009 |
Взятие крови из периферической вены |
0,900 |
2,000 |
|
A12.05.005 |
Определение основных групп крови (А, В, 0) |
0,050 |
1,000 |
|
A12.05.006 |
Определение резус-принадлежности |
0,050 |
1,000 |
|
A12.05.007 |
Определение подгруппы и других групп крови |
0,050 |
1,000 |
|
A12.05.011 |
Исследование железосвязывающей |
0,500 |
0,700 |
|
A12.05.015 |
Исследование времени кровотечения |
0,050 |
1,000 |
|
A12.05.016 |
Исследование свойств сгустка крови |
0,050 |
1,000 |
|
A12.05.017 |
Исследование агрегации тромбоцитов |
0,050 |
4,000 |
|
A12.05.027 |
Определение протромбинового |
0,500 |
0,500 |
|
A12.05.028 |
Определение тромбинового времени в крови |
0,050 |
1,000 |
|
A12.05.035 |
Исследование активности и свойств фактора |
0,500 |
0,500 |
|
A12.05.035.002 |
Анализ мультимеров фактора Виллебранда в |
0,100 |
1,000 |
|
A12.05.035.003 |
Коллагенсвязывающий тест |
0,100 |
1,000 |
|
A12.05.035.004 |
Специфический тест способности фактора |
0,010 |
1,000 |
|
A12.05.039 |
Определение времени свертывания плазмы крови, активированного каолином и (или) |
0,050 |
1,000 |
|
A12.05.049 |
Определение активности ингибиторов к |
0,050 |
1,000 |
|
A12.05.054 |
Исследование адгезии тромбоцитов |
0,500 |
1,000 |
|
A13.29.003 |
Психологическая адаптация |
0,100 |
1,000 |
|
A13.29.007 |
Психологическая коррекция |
0,100 |
1,000 |
|
A13.29.011 |
Социально-реабилитационная работа |
0,500 |
1,000 |
|
A14.12.001 |
Уход за сосудистым катетером |
0,010 |
130,000 |
|
A19.05.001 |
Лечебная физкультура при заболеваниях |
0,300 |
120,000 |
|
A20.30.001 |
Ванны минеральные |
0,300 |
10,000 |
|
A20.30.012 |
Воздействие климатом |
0,300 |
21,000 |
|
A26.06.034 |
Определение антител классов M, G (IgG, IgM) |
0,900 |
1,000 |
|
A26.06.036 |
Определение антигена к вирусу гепатита В |
0,900 |
1,000 |
|
A26.06.041 |
Определение антител классов M, G (IgM, IgG) |
0,900 |
1,000 |
|
A26.06.043 |
Определение антител классов M, G (IgM, IgG) |
0,010 |
1,000 |
|
A26.06.044 |
Определение антител классов M, G (IgM, IgG) |
0,010 |
1,000 |
|
A26.06.048 |
Определение антител классов M, G (IgM, IgG) |
0,900 |
1,000 |
|
A26.06.049 |
Определение антител классов M, G (IgM, IgG) |
0,900 |
1,000 |
|
A26.06.063 |
Определение антител классов M, G (IgM, IgG) |
0,100 |
1,000 |
|
A26.06.082 |
Определение антител к бледной трепонеме |
0,050 |
1,000 |
|
B01.001.001 |
Прием (осмотр, консультация) врача-акушера- |
0,100 |
1,000 |
|
B01.001.002 |
Прием (осмотр, консультация) врача-акушера- |
0,100 |
6,000 |
|
B01.005.001 |
Прием (осмотр, консультация) врача- |
1,000 |
1,000 |
|
B01.005.002 |
Прием (осмотр, консультация) врача- |
1,000 |
4,000 |
|
B01.010.001 |
Прием (осмотр, консультация) врача-детского |
0,100 |
1,000 |
|
B01.020.001 |
Прием (осмотр, консультация) врача по |
0,500 |
2,000 |
|
B01.023.001 |
Прием (осмотр, консультация) врача- |
0,050 |
1,000 |
|
B01.023.002 |
Прием (осмотр, консультация) врача- |
0,200 |
1,000 |
|
B01.028.001 |
Прием (осмотр, консультация) врача- |
1,000 |
1,000 |
|
B01.028.002 |
Прием (осмотр, консультация) врача- |
0,300 |
1,000 |
|
B01.050.001 |
Прием (осмотр, консультация) врача – |
0,050 |
1,000 |
|
B01.050.002 |
Прием (осмотр, консультация) врача – |
0,100 |
2,000 |
|
B01.054.001 |
Осмотр (консультация) врача-физиотерапевта |
0,500 |
2,000 |
|
B01.064.003 |
Прием (осмотр, консультация) врача- |
0,800 |
1,000 |
|
B01.064.004 |
Прием (осмотр, консультация) врача- |
0,500 |
1,000 |
|
B02.069.001 |
Прием (тестирование, консультация) |
0,100 |
1,000 |
|
B02.069.002 |
Прием (тестирование, консультация) |
0,100 |
3,000 |
|
B03.016.003 |
Общий (клинический) анализ крови |
1,000 |
1,000 |
|
B03.016.004 |
Анализ крови биохимический |
1,000 |
1,000 |
|
B03.016.006 |
Анализ мочи общий |
0,050 |
1,000 |
|
B04.020.001 |
Диспансерный прием (осмотр, консультация) |
0,500 |
1,000 |
|
B04.020.002 |
Профилактический прием (осмотр, |
0,200 |
1,000 |
|
B04.069.001 |
Школа психологической профилактики для |
0,500 |
2,000 |
4.13.3 Характеристика алгоритмов и особенностей применения медицинских услуг при данной модели пациента
Значение и оценка клинической картины
В настоящее время оценке клинической картины заболевания придается большое значение. Наличие геморрагических проявлений у пациента позволяет заподозрить бВ. Геморрагические проявления при бВ не имеют нозологической специфики и могут быть сходны с проявлениями других геморрагических состояний.
Однако для бВ наиболее характерны кровотечения со слизистых оболочек. Значимые кровотечения типичной локализации необходимо учитывать при диагностике. Ниже перечислены наиболее типичные проявления, требующие тщательного, часто неоднократного лабораторного обследования для диагностики бВ:
-
Не менее 2х эпизодов спонтанных носовых кровотечений, не останавливающихся под воздействием 10 минутной компрессии или не менее 1 эпизода, потребовавшего гемотрансфузии.
-
Длительные (более 15 минут) кровотечения из обычных ран или кровотечения из обычных ран, рецидивировавшие в течение 7 дней после травмы.
-
Кожные геморрагические проявления, в том числе избыточное образование синяков не соответствующие характеру травмирующего воздействия.
-
Кровотечения со слизистых полости рта, потребовавшие медицинской помощи, в том числе: десневые кровотечения, кровотечения при смене зубов, ушибах губ или травмах языка.
-
Спонтанные желудочно-кишечные кровотечения, которые потребовали медицинской помощи или
приводящие к острой или хронической анемии, не объясняющиеся язвами или портальной гипертензией. -
Тяжелые длительные или рецидивирующие кровотечения, требующие медицинской помощи,
возникающие после экстракции зубов и других операций на органах полости рта и носоглотки. -
Маточные кровотечения, приводящие к острой или хронической анемии или требующие
медицинской помощи, не связанные со структурными изменениями матки. -
Другие кровотечения со слизистых или кожи, требующие медицинской помощи.
В типичных случаях геморрагические проявления носят системный характер, то есть развиваются там, где происходит повреждение сосуда.
Еще одним, недавно описанным признаком бВ является склонность к образованию грубых рубцов. До определенного момента этот признак может быть единственным.
Отсутствие геморрагических проявлений не позволяет исключить бВ, особенно, если у пациента не было провокаций (значительных травм, операций или инвазивных манипуляций).
Лабораторная диагностика
В основе диагностики бВ лежит лабораторная оценка активности фВ. Поскольку активность фВ при нетяжелых формах бВ может значительно повышаться в следствие различных воздействий, таких как стресс, воспаление, травма, беременность, у пациентов с подозрением на бВ и нормальным уровнем активности фВ
необходимо проводить несколько исследований. При выборе сроков проведения исследования надо учитывать наличие симптомов воспаления. У менструирующих женщин желательно выполнять отбор образцов на 1 — 2 день менструации. При выполнении отбора образцов у детей, надо учитывать, что стресс от
ожидания манипуляции, и сложности венепункции, удлиняющие процедуру отбора образца приводят к повышению активности фВ и невозможности получения правильного результата.
При проведении лабораторной диагностики необходимо решить следующие задачи:
-
выявить лабораторные признаки снижения активности фВ
-
уточнить форму бВ
-
провести дифференциальный диагноз с другими геморрагическими состояниями
Диагностические тесты
-
Тесты оценки специфической активности фВ:
-
Ристомицин кофакторная активность или аналогичные тесты
-
Коллаген связывающая активность,
-
Фактор VIII связывающая активность,
-
-
Другие диагностические тесты:
-
Время кровотечения, выполненное стандартизованным методом
-
Подсчет количества тромбоцитов
-
Агрегация тромбоцитов с ристомицином (ристоцетином или аггристином) выполняется со стандартной концентрацией реактива (1 мг/мл) и с реактивом, разбавленным в 2 — 4 раза (менее 0,8 мг/мл)
-
Определение активности ф. VIII свертывания крови
-
Определение концентрации антигена фВ
-
Анализ мультимерной структуры фВ методом электрофореза
-
-
Дополнительные тесты
-
Определение группы крови
-
Значение и оценка лабораторных данных
Лабораторные признаки снижения специфической активности фВ являются основными для диагностики бВ. В настоящее время нет общепризнанных «нормальных» показателей активности фВ. Однако, если при неоднократном исследовании не выявлено снижения активности фВ ниже 50%, диагноз бВ маловероятен.
Соотношение активности и количества фВ (антигена фВ) у здоровых лиц составляет не менее 0,7.
При оценке результатов лабораторных тестов необходимо учесть вариабельность активности фВ: у одного и того же пациента с 1 и 2 типами бВ активность фВ может варьировать в широких пределах. В сомнительных случаях, для диагностики, обследование необходимо проводить неоднократно.
Необходимый объем исследований:
Различные формы бВ требуют различного объема лабораторных исследований.
-
Во всех случаях для диагностики бВ необходимо провести следующие тесты: определение времени кровотечения стандартизованным методом;
-
группа крови и резус-фактор;
-
подсчёт количества тромбоцитов;
-
АЧТВ;
-
ПВ;
-
ТВ;
-
концентрация фибриногена;
-
ристомицин кофакторная активность фВ или аналогичные тесты;
-
активность фVIII;
-
агрегация тромбоцитов с индукторами агрегации и ристомицином/ристоцетином или аггристином);
-
концентрация антигена фВ.
Для дифференциальной диагностики типов 1 и 2 помимо перечисленных выше может потребоваться проведение анализа мультимеров фВ.
В сомнительных случаях: умеренная клиническая картина при нормальной ристомицин кофакторной активности фВ показано проведение анализа коллаген-связывающей активности фВ.
При клинике умеренной тромбоцитопении с геморрагическим синдромом показано проведение теста агрегации тромбоцитов с низкими концентрациями ристомицина (ристоцетина или аггристина)
У пациентов с изолированным умеренным снижением фVIII (активность более 5%) или данными за аутосомное наследование показано проведение теста фактор VIII связывающей активности фВ.
4.13.4 Требования к лекарственной помощи
Требования к лекарственной помощи в стационаре представлены в таблице 19.
| Фармакотера певическая группа |
Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Фактор свертывания крови |
1,000 |
4000 МЕ |
32000 МЕ |
||
|
Аминокапроновая кислота |
0,400 |
5000 мг |
70000 мг |
||
|
Транексамовая кислота |
0,400 |
1000 мг |
42000 мг |
||
|
Железа {III} гидроксид |
0,400 |
2700 мг |
27000 мг |
||
|
Этамзилат |
0,300 |
750 мг |
67500 мг |
||
|
Гидрокортизон |
0,050 |
50 мг |
100 мг |
||
|
Эритромасса с удаленным |
0,150 |
600 мл |
600 мл |
||
|
Отмытые эритроциты |
0,050 |
600 мл |
600 мл |
||
|
Свежезамороженная |
0,050 |
1200 мл |
1200 мл |
||
|
Бетаметазон |
0,050 |
5 мг |
15 мг |
||
|
Дезогестрел + |
0,400 |
600 мг + 120 мг |
36000 мг + |
||
|
Тромбоконцентрат |
0,100 |
3 мл |
3 мл |
||
|
Железа сульфат |
0,200 |
100 мг |
6000 мг |
||
|
Железа {III} гидроксид |
0,200 |
100 мг |
6000 мг |
Требования к амбулаторной лекарственной помощи представлены в таблице 20.
| Фармакотера певическая группа |
Анатомо-терапевтическая химическая группа |
Международное непатентированное наименование |
Частота назначений |
Ориентировочная суточная доза |
Эквивалентная курсовая доза |
|---|---|---|---|---|---|
|
Фактор свертывания крови |
0,100 |
1500 МЕ |
237000 МЕ |
||
|
Фактор свертывания крови |
0,500 |
2000 МЕ |
100000 МЕ |
||
|
Аминокапроновая кислота |
0,400 |
5000 мг |
105000 мг |
||
|
Транексамовая кислота |
0,400 |
1000 мг |
42000 мг |
||
|
Железа {III} гидроксид |
0,400 |
2700 мг |
27000 мг |
||
|
Этамзилат |
0,300 |
750 мг |
67500 мг |
||
|
Дезогестрел + |
0,400 |
600 мг + 120 мг |
36000 мг + 7200 мг |
||
|
Диеногест + |
0,200 |
2,0 мг + 0,03 мг |
312,0 мг + 4,68 мг |
||
|
Железа сульфат |
0,200 |
100 мг |
6000 мг |
||
|
Железа {III} гидроксид |
0,200 |
100 мг |
6000 мг |
||
|
Десмопрессин |
0,20 |
9 мг |
18 мг |
Приведенные в форме дозы препаратов являются ориентировочной величиной. В каждом конкретном случае доза препаратов должна быть подобрана пациенту индивидуально. 10% пациентов требуют постоянного рпофилактического лечения. Эквивалентная курсовая доза – рассчитана для лечения по схеме 1500 МЕ х 3 раза в неделю на 1 год терапии. 70% пациентов должны получать терапию «по требованию». Во всех случаях необходим индивидуальный расчет разовой и курсовой дозы.
Использование эстроген содержащих препаратов показано как основная или дополнительная терапия маточных кровотечений.
4.13.5 Характеристики алгоритмов и особенностей применения медикаментов
В основе лечения бВ лежит проведение специфической заместительной терапии (терапии, направленной на повышение активности фВ в крови). Специфическая заместительная терапия проводится 2 классами препаратов: препаратами десмопрессина и концентратами фВ (КфВ), как правило, входящего в состав
концентратов фVШ.
Специфическая заместительная может проводиться с целью:
-
Профилактика или остановка острых кровотечений. Терапия назначается на определённый период времени, в течение которого имеется риск патологического кровотечения. В дальнейшем терапия прекращается и возобновляется при появлении значимого риска кровотечения или развитии геморрагических проявлений.
-
Профилактика поражения опорно-двигательного аппарата и инвалидизации у пациентов с 3 и тяжёлым 1 типом бВ. Терапия назначается, как минимум до достижения 18 лет, либо пожизненно. В процессе наблюдения проводится коррекция лечения, но перерывы недопустимы.
Препараты для проведения специфической гемостатической терапии.
Десмопрессин
Синтетический аналог антидиуретического гормона вазопрессина — 1- дезамино-8Б-аргинин-вазопрессин (ДДАВП) является стимулятором высвобождения фВ из депо, что приводит к повышению его концентрации в плазме. Наиболее эффективно применение ДДАВП при 1 типе бВ, возможет эффект при типе 2А.
После введения десмопрессина активность фВ возрастает через 30 минут. Повышенная концентрация фВ в плазме сохраняется в течение 8 — 10 часов. Повторное применение этого препарата допустимо через сутки после предыдущего.
Десмопрессин вводится внутривенно капельно, в дозе 0,3 мкг/кг в 50 — 100 мл физиологического раствора в течение 20 — 30 минут 1 раз в сутки, подкожно в аналогичной дозировке, либо интраназально в дозе 300 мкг
(по 150 мкг в каждую половину носа). Индивидуальный ответ на применение ДДАВП у пациентов может значительно отличаться. После установления диагноза, пациентам, которые являются потенциальными кандидатами для терапии ДДАВП, целесообразно проводить анализ эффективности этого препарата,
исследуя тест восстановления активности фВ и фVIII в крови через 60 мин. после введения и период
полувыведения фВ и фVIII.
Применение ДДАВП более 1 — 2 дней подряд формирует тахифилаксию, и эффективность этого лечения снижается. Причина тахифилаксии — уменьшение количества, депонированного фВ.
Описан ряд побочных эффектов и осложнений лечения десмопрессином. Гиперемия лица, тахикардия, головная боль являются следствием вазомоторного действия препарата, чаще эти симптомы возникают при его внутривенном введении. Эти проявления можно уменьшить, продлив время введения препарата. Более
серьезными осложнениями являются гипонатриемия и водная интоксикация, как следствие антидиуретического эффекта. Осложнения встречаются относительно редко, и для их профилактики рекомендуется во время лечения ограничивать объем принимаемой жидкости. Препарат не рекомендуется применять у детей до 3х лет.
Препараты фВ
Как правило, входят в состав концентратов фVIII. Могут применяться при всех типах бВ у детей любого возраста. Мы рекомендуем использование тех препаратов фVIII с фВ, эффективность которых у пациентов с бВ была доказана в клинических исследованиях.
У детей необходимо использовать очищенные вирусинактивированные КфВ. В плановом порядке показано применение тех препаратов, у которых известно содержание фВ.
Для оказания экстренной гемостатической помощи, если препараты с известной активностью фВ отсутствуют, возможно использование других КфВ.
КфВ, не содержащие фVIII. могут применяться для ведения пациентов с бВ. Эти препараты показаны для длительной (постоянной) профилактической заместительной терапии или плановой краткосрочной заместительной терапии при предстоящем оперативном лечении, выполнении инвазивных манипуляций,
перед началом менструаций.
В случае плановой краткосрочной заместительной терапии КфВ начинают вводить не менее чем за сутки до ожидаемого провоцирующего события.
Неочищенные препараты, содержащие фВ: криопреципитат и свежезамороженная плазма. Применение этих препаратов для коррекции активности фВ у детей с бВ не показано. Исключение составляют ситуации, при которых имеется угроза для жизни пациента, а другие препараты, содержащие фВ не доступны.
Расчёт дозы КфВ с известной активностью фВ
У детей младшего возраста:
Доза (МЕ)= масса тела х (желаемый уровень фВ в % — базальный уровень фВ в %) х 0,75 У детей старшего возраста:
Доза (МЕ)= масса тела х (желаемый уровень фВ в % — базальный уровень фВ в %) х 0,5.
При использовании препаратов КфВ с неопределённой активностью фВ расчёт необходимо проводить по фVIII и увеличивать дозу на 20% — 50%.
Особенности использования КфВ
При расчете необходимой дозы учитывать содержание препарата в 1 флаконе. Учитывая высокую стоимость
препаратов КфВ, всё содержимое флакона вводится пациенту без остатка. При этом минимально
необходимое рассчитанное количество препарата округляется в большую сторону. Исключение возможно
при лечении детей первого года жизни. Принципы проведения заместительной терапии.
Заместительная терапия для профилактики и остановки острых кровотечений
Выбор препаратов:
-
У детей до 3 лет применяют КфВ. При недостаточной эффективности, помимо КфВ при 3 или 1 типе
показано введение концентрата тромбоцитов. -
У детей старше 3 лет.
В таблице 24 представлены рекомендации по выбору препарата при незначительных геморрагических проявлениях, требующих одно-, максимум двукратного лечения:
-
ушибы,
-
неглубокие раны,
-
начинающиеся маточные кровотечения,
-
носовые кровотечения,
-
признаки начинающихся гематом мягких тканей конечностей,
-
физиологическое выпадение зубов,
-
кровотечения при небольших травмах слизистой рта или носа,
При более значимых проявлениях показаны препараты КфВ:
-
гемартрозы,
-
тяжелые травмы,
-
кишечные кровотечения,
-
массивные гематомы мягких тканей,
-
кровоизлияния в ЦНС,
-
кровоизлияния и кровотечения в органы грудной клетки,
-
кровотечения в брюшную полость, гематомы органов брюшной полости,
-
кровоизлияния в другие жизненно-важные органы
-
недостаточная эффективность от ДДАВП
| Тип бВ | Основной препарат | Дополнительный препарат |
|---|---|---|
|
1 хорошо реагирующие на |
ДДАВП |
КфВ |
|
1 плохо реагирующие на ДДАВП |
КфВ |
Тромбоконцентрат |
|
2А |
КфВ |
ДДАВП |
|
2В |
КфВ |
|
|
2М |
КфВ |
|
|
2N |
КфВ |
|
|
3 |
КфВ |
Тромбоконцентрат |
Дозы, кратность и длительность лечения должны быть увеличены, если эффективность гемостатической терапии недостаточна.
При лечении отдельных проявлений, показано проведение дополнительных гемостатических мероприятий (применение ингибиторов фибринолиза, концентрата тромбоцитов, местных гемостатических препаратов, хирургических методов гемостаза).
Кратковременная профилактическая заместительная терапия показана при рецидивирующих геморрагических проявлениях. Длительность определяется характером проявлений. Наиболее частые причины: маточные кровотечения, носовые кровотечения, хроническая патология желудочно-кишечного
тракта в стадии обострения, при которой высок риск кровотечения.
Заместительная терапия для профилактики поражения опорно-двигательного аппарата
Показания:
-
3 тип бВ
-
повторное кровоизлияние в сустав при других типах бВ Особенности:
-
Проводится непрерывно.
-
Доза и кратность могут увеличиваться при развитии интеркуррентных заболеваний, для профилактики кровотечений при травмах и инвазивных манипуляциях.
-
Требует регулярного клинического и лабораторного контроля (см раздел «Лабораторный контроль эффективности терапии»)
Показания и сроки начала:
-
3 тип бВ. Начало после однократного эпизода гемартроза. Длительность — пожизненно
(неопределенно долго). -
Другие типы бВ. Начало сразу после 1 — 2 эпизода гемартроза.
Схема первичной профилактической заместительной терапии.
20 — 40 МЕ/кг ФVIII с фВ 1 раз в 2 — 3 дня, либо 3 раза в неделю.
Другие гемостатические препараты.
Концентрат тромбоцитов. Применяется с гемостатической целью у пациентов с 3, тяжёлым 1 типами бВ при недостаточном эффекте от адекватной дозы КфВ.
4.13.6 Требования к режиму труда, отдыха, лечения или реабилитации
Ограничения в соответствии с текущим статусом пациента
4.13.7 Требования к уходу за пациентом и вспомогательным процедурам
Соблюдение пациентами правил личной гигиены. Требования в соответствии с текущим статусом.
4.13.8 Требования к диетическим назначениям и ограничениям
При наличии аллергоанамнеза исключать причинно-значимые продукты.
4.13.9 Особенности информированного добровольного согласия пациента при выполнении протокола ведения больных и дополнительная информация для пациента и членов его семьи
Информированное добровольное согласие пациент (опекун пациента) дает в письменном виде.
Пациенту (опекуну) следует объяснить необходимость и правила режима, диеты, необходимость фармакологической интервенции.
4.13.10 Правила изменения требований при выполнении протокола и прекращение действия требований протокола
Протокол перестает действовать после выполнения трансплантации эпителиальной ткани тимуса (медицинская помощь пациенту оказывается в соответствии с требованиями соответствующего протокола).
4.13.11 Возможные исходы и их характеристика
Возможные исходы Болезни Виллебранда и их характеристика представлены в таблице 22.
| Наименование исхода |
Частота развития, % |
Критерии и признаки | Ориентировочное время достижения исхода, лет |
Преемственность и этапность оказания медицинской помощи |
|---|---|---|---|---|
|
Летальный исход |
<0.1% |
Наступление смерти |
– |
|
|
Контроль |
Лечение гемофилии — схема
Лечение пациентов с гематомией основано на семи общих принципах. 1) Своевременно провести клинические тесты и клинические испытания, поставить диагноз как можно скорее и начать лечение. 2) В результате расслабляющие пациенты, на которые подвергается сильной болью тяжелой болью. 3) Утром пациентов с гемофилией он начинается с перфузии, а затем выполняет другие действия. Ежедневная работа в больнице — это уход за пациентами с исключительными графиками. 4) аспирин и морфин должны быть классифицированы по объему гемофилии. 5) Следует исключить внутримышечные инъекции, а подкожные инъекции должны использоваться исключительно. 6) Обработки соответствующим образом выбираются, вводятся и достаточно продолжаются, так что максимальный эффект может быть получен и не существует риска рецидива. 7) Заместительница терапии и з-за дефектных факторов является основой ант и-кулинарного лечения.
Такое лечение включает в себя шесть основных элементов, Utvjabkbb. -потому что тип гемофилии и степень тяжести (определите концентрацию коэффициента дефицита в плазме, которая является стандартом для начала лечения). -Содевая кровотечение и его причины точно. -Телом пациента. -Берская половина жизни введенных факторов. (Интервал перфузии определяется на основе этого). -Вист знание типа используемого препарата и концентрации антигемофильных факторов в нем. (Установите количество перфузии для перфузии и количество перфузии в день на основе этого). -Пропликационно оценить период лечения на основе клинического курса пациента и результатов испытаний.
Современное лечение гемофилии сложное и выполняется из трех аспектов.
а) Лечение геморрагического приступ а — имеющее своей целью наиболее скорое прекращение геморрагии. Ежедневно вводится путем перфузии антигемофилический материал, а именно: 1) Консервированная кровь , будучи совершенно лишенной Ф. VIII, не должна использоваться при гемофилии А; однако она содержит Ф. IX (0,5 Ед/мл) и поэтому ее можно использовать при гемофилии В. Свежая кровь имеет хороший эффект при обоих типах гемофилии, при условии ее введения путем прямой трансфузии (донор => Это связано с гематомией) и гидроматизацией. Использование свежей крови необходимо, чтобы получить много крови, чтобы получить хорошие результаты, так что это единственное лечение.
2) Свежая плазма, используемая в течение 2 часов после сбора крови, может использоваться для обоих типов дружелюбия гематомот, включая 1u на 1 U на мл. Если замороженный хранится, его можно хранить, потому чт о-30 ° имеет 6-месячную дату истечения срока действия. Это требует довольно большого объема, поэтому вам следует избегать перегрузки кровообращения.
3) Период хранения замороженной и высушенной ант и-гематопилемской плазмы составляет два года. Если последний фургон вводится в половине неразбавленного раствора, концентрация F.VIII и IX будет удвоена, и она может быть хорошо применена к объему пациентов, получающих это лечение.
4) Cryoprecitatite — это концентрированный концентрат P. VIII + P. I, который очень прост и экономичен, полученный специальным морозовым раствором. Его можно использовать только для гемофилии А. Доза составляет около 150 мл и содержит около 40 до P.VIII, что очень подходит для введения больших доз в небольшом количестве. Температура хранения составляе т-30 ° C, а период хранени я-3 месяца. Если вы не используете его сразу после оттаивания при 37 ° C, он будет инактивирован. Период хранения замороженных высушенных товаров составляет один год. Половина жизн и-8 часов.
5) Cohn, Kekwick и Blomback Francs у меня период хранения 18 месяцев, имею высокое содержание F. viii-c и замораживается в 50 мл (10 ед/мл) при концентрации, близкой к клио-белковому. Это дренажная подготовка. Это полезно только для гемофилии А, потому что он не содержит фибриногена (F. I). Половина жизн и-12 часов.
6) Антигемофильный глобулин (чистый, концентрированный) является наиболее активным и чистым для f. VIII-C. Существуют замороженные препараты для сушки (эффект 18 месяцев), для людей (250, 500, 1000 единиц) и для животных (5000 единиц). Половина жизни 15 часов.
7) P.P.S.B. содержит F.II, VIII, IX и X с замораживающими и сухими продуктами (18 месяцев в горшке). Он используется только для гемофилии B и содержит 100 IU (для педиатрического), 250, 500, 1000IU (концентрация взрослых). Половина жизни составляет 24 часа.

Дополнительная терапия использует введение антигемофильных факторов по мере необходимости. E-ASA (подавление потенциальных тривиальных линий), антибиотики (когда существует риск инфекции кровотока), флавоноид + вита Облегчение (облегчение боли: ацетаминофен, буферизатор, форма), седативное (седация всего тела пациента), U-Глобулин (профилактика гепатита трансфузия) и антигистаминные препараты (для аллергических реакций).
Все эти препараты ограничены внутривенным или пероральным введением, а инъекции в мышцах запрещены, а подкожные инъекции исключительно вводят в место впрыска под брюшной кожей в течение 5 минут с 1 2-й иглой.
Лечение ант и-гематоматическими препаратами выполняется как перфузия с помощью фильтра свободного падения. При использовании шприца он очень медленный (10 мг/мин), инъекция с очень низким давлением, а игла должна иметь фильтр. Используйте специальный тип (Micronite) с отверстием 40U для фильтра.
Растворение (замораживание сушки) или разложение (замораживание) состава должно быть выполнено быстро, не встряхивая пузырьки, которые будут получены при 37 °. Если вы отклоняетесь от этих критериев, активность подготовки уменьшится. Сразу после роспуска.
Альтернативная терапия должна быть должным образом вводиться и постоянно своевременно. Он используется в форме быстрой перфузии (150 капель/ минут). Тем не менее, необходимо предотвратить чрезмерное лечение с учетом возможности антифактора.
Небольшое кровоизлияние легко устраняется, когда антигемофильный глобулин составляет около 20 %, но это выполняется путем введения антигемофильной замороженной сухой плазмы за кг/12 часов, а период лечения составляет от 2 до 3. Это день.
В случае среднего кровотечения используется антигемофильная плазма, но уровень для увеличения отсутствующего фактора составляет 30 %. Это может быть достигнуто путем введения 15 мл плазмы на кг в течение 12 часов. Период лечения составляет 3-5 дней.
В случае большого кровотечения антигемофильная плазма составляет 25 мл/кг веса/12 часов, что требует 50 % -ного уровня дефектного глобулина. Учитывая, что сумма большая, примените ее пополам пополам (применяется каждые 6 часов). Для гемофилии A, Clio Precipate или Fr. I пронизывает 50U/ кг дозировки веса/ день каждые 12 часов, а болезнь гематомо B — та же доза, P.P.S.B. Период лечения составляет от 7 до 14 дней.
В случае катастрофического кровотечения в течение первых 3-5 дней Cli o-Procepate или FR.t вводятся до 80U/ кг/ день в CLI O-белок или FR.T, а P.P.S.B вводится в гемофилию B, и и 4 ~ 4 ~. В течение 8 дней низкие дозы (50U/ кг веса/ день) продолжаются.
Местная терапия, на которую приходится 30 % ант и-кулинарного лечения, не следует пренебречь ни в каком случае. Это главная цель этого, особенно для кровоточащих органов, чтобы отдохнуть. В конечностях используются спринты, кишки, эластичные повязки, мешки с песком и т. Д.
Современное понимание того, что исправление актером должно быть коротким периодом (3-5 дней) и не является абсолютным, и это больше не является практичным. Если кровотечение останавливается, будет практиковаться ранняя мобилизация (массаж, пассивное движение, постепенная механическая терапия, активное движение движения в воде и воде, активация в воздухе).
Рекомендуется положить ледяной мешок (Termofix или гибкий холодный пакет) на место кровотечения в течение периода отдыха.
Нанесите заправку и фибриновую пленку, содержащую тромбин в губке на открытие губки. Наконец, в случае очистки зубов десны защищают десны с очень прилипшей пластиковой пластиной.
Очень спорное обсуждение заключается в прокол в разгар артрита с пустым артритом. До появления концентрированной антигематомотомии пункция была строго запрещена. Это больше не противопоказано, но медицинское лечение для устранения кровотечения было усилено, и оно заканчивается рано, поэтому необходимость больше не нужна.
В то время необходимо ввести 500-1000IU факторов антигемофилии, сделать иглу более тонкой, обращать внимание на всасывание и выполнять сжатие повязки после прокола.
Ант и-гематопрофрофин г-фактор лечение гемофилии и з-за антител и з-за антител
Обратитесь к политике лечения пациентов с гемофилие й-типом, у которых развились плазменные хибиттеры (ант и-PH.VII I-антитела) во время лечения острых кровоточащих заболеваний. 1) Для пациентов с ингентовой мощностью 10 U B/мл, в больших количествах следует вводить в чистую концентрированную P.VIII в течение примерно 10 дней с дозой веса в 100 ед/кг/день или геморрагическим синдромом исчезает. 2) Для пациентов с ингибиттерской мощностью от 10 до 30 U B/мл, в дополнение к методам лечения, описанных в точке 1, половина дозы (веса/кг веса/день) дозы (вес 50 ед/кг) добавлены в то же время. и администрировать.
3) Для пациентов с 30-50U Б/мл с ценой с ингибитором, лечение проводится с иммунодепрессантом в 2. Лечение. -Clohos famide составлял 8 мг/кг веса вес/мас./Шт/вес и 3 мг/кг веса веса/масса,-прозвучал 2 мг/кг веса со счетом 1-5-го дня.
4) Для пациентов с ингибиттерской мощностью более 50 единиц B/мл выполняется лечение абзацев, но плюс галфеиз должен быть выполнен заранее. Для этой цели машины Aminco-Hemonetics используются в течение 120 минут на скорости работы 20 мл/мин. Повторно вводит свой рецепт, который был удален всю плазму пациента и респондент плазму здорового человека в IS-группе ISO-RH, и количество факторов анти-хеморрации, указанных схемой (3). Добавлено.
Сессии Plasmafelesis могут проводиться раз в два дня или по мере необходимости.
б) Цель заболевания гематомии в случае хирургической хирургии состоит в том, чтобы остановить гемостатическое кровоизлияние во время операции и остановить кровоизлияние перед раной после заживления операции.
F.VIII концентрированная формула (Cryio, Fraction I, Pure Globulin) или F.IX (P.P.S.B.) используется в качестве эффективных лекарств. Плазма не используется, потому что объем слишком большой.
Лечение: умеренная хирургическая хирургия (резекция генетической пленки, мизшень , период лечения составляет от 7 до 14 дней.
В случае основной хирургической хирургии (брюшная полость, грудь, таз, резание, пакелэктомия, резекция остаточных кист, резекция хряща кости, уменьшение кровотечения переломов, коррекция аномалии положения конечности, расширение сухожилий, замена сустава, резка костей. 。Laminectomies, секвестротомии, разрез фиброзной фасции, челюстн о-лицевой грунт, экстракция терминальных зубов, нейрохирургическое вмешательство) 達成す べき レベル は 不足 係 数 の 80 % 、 、 濃縮 を 使用 する 必要 が あり ます (v 、 、 係数 を する 必要 が ます (((% 、 係数 を する 必要 が ます (((((((((((( IX) вводится в течение 7 дней с дозой веса/ кг/ кг, а в течение 7 дней с дозой веса/ кг/ кг в день, последние семь дней теряют вес до 40 лет/ кг/ день и перфузии каждые 12 часов. держать.
Чтобы всесторонне судить выше, мы представляем диаграмму (тип лечения), которая всесторонне показывает все вышеперечисленные ситуации и возможности. Конечно, он предназначен как ценное руководство для выполнения интеллектуальной и эффективной альтернативной терапии, но эти данные не следует принимать, поскольку это потому, что количество вариантов чрезвычайно широко в зависимости от пациента. Наиболее правильное лечение основано на этой схеме, по сравнению с результатами клинического прогресса и клинических тестов (биологический мониторинг лечения), и каждый пациент индивидуально адаптируется к пациентам.
Схема лечения гемофилии
| Категория кровотечения | Уровень отсутствия кровоточащих факторов для кровотечения | Врач/12 часов | Период лечения |
| I. Носовое кровотечение, пероральное кровотечение, легкие открытые поражения, легкая гематурия, снижение клетки крови, общая гематома | 20% | 10 единиц/кг веса | 2-3 дня |
| II. Опасная гематома: мышца PSOAS, шея, кожа головы, ладонь, сгибание предплечья. Средняя открытая скорость. Стоматологическая добыча. Желудочн о-кишечное кровотечение, умеренная гематурия. Хирургическое вмешательство в легкие. В случае закрытого перелома. Физиотерапия для коррекции аномалий положения | 30% | 15 кредитов/кг веса | 3-5 дней |
| III. Подобочное кровоизлияние брюшного кровотечения. Потребление кровоизлияния. Появляются открытые переломы, большая открытая гематурия. Средняя хирургия: подраздел, тонзилларэктомия, лечение геморроя, удаление перегородки, хирургия гортани, офтальмологическая хирургия, мастерская ортодонтия среднего размера и з-за ортопедической хирургии | 50% | 25 кредитов/кг веса | 7-14 дней |
| Iv. Клетчатка центральной нервной системы, основное хирургическое вмешательство: брюшная полость, грудь, таза, резание, патерэктомия, отцовская резекция, резекция почек, удаление предстательной железы, удаление хряща в кости, снижение кровотечения мошенничества. , секвестломия, хирургия челюсти / лица, вмешательство нейрохирургии | 80% | 40 единиц/кг веса тела | 10-1 1-го |
Правильно применяемое и организованное восстановление может оказать огромное влияние на гемофилию по сравнению с ситуацией таких пациентов 25-30 лет назад. Однако не теряйте отслеживания того факта, что это лечение может привести к некоторым неприятным результатам для некоторых пациентов (к счастью). В результате возникновение и начало ингибитора, возникновение гемолитической анемии (наряду с анти-кровоточащими препаратами, специфическим типом крови аггульхинина для пациентов), гепатит после переливания (тип B или не A-Non-B), дополнительно Хотя нет клинических симптомов, вызывает экспрессия хронического гепатита с прогрессом к циррозу.
РЕДАКТИРОВАТЬ: ИСКАНДАЛ МИЛИФСКАЯ ПУБЛИКАЦИЯ ДАТА ОБНОВЛЕНИЯ. 18.3.2021
Гемофилия у детей
Болезнь гематомии является гемостатической системой, которая характеризуется снижением или инвалидностью коагуляционного фактора крови VIII или IX (Proberems of Standars в здравоохранении, Москва, 2006, с. 18].
Код протокола: P-P-018 «Детская гематомия» Профиль: Детская стадия: PHC ICD-10 Код (множественные).
Автоматизация клиники: быстрая и дешевая
-Повторно 300 клиник в 4 странах
-800 RUB / 4500 KZT / 27 BYN — -1 Рабочая станция / месяц
Автоматизация клиники: быстро и дешево
- Подключить 300 клиник в 4 странах
- 1-е мест о-800 RUB / 4500 KZT / 27 BYN / месяц
Мне интересно! Запросы
Классификация
Классифицируется профессором Якуниной Л.Н. [Детская гемофилия (медицинское лечение, диагноз, лечение), М., 2003, с.6). ]
Факторы и группы риска
Диагностика
Диагностические стандарты:-Сообщение жалоб при кровотечении и органах крови-наличие или отсутствие кровотечения у родственников, возраст кровотечения.
-Визуальные тесты в кровоточащих органах и животных, пятнах или не к клеткам крови.
-Сет хирурговой посещение (тесты, обследования) -confirmation гематоза. Существование деформированного остеоартрита, подозрение на внутренний перелом.
-Как послеродовых осложнений имел синдром кровотечения (материнское кровотечение, пуповительное кровотечение, новорожденная кефарогематома)?
-Када была операция (включая экстракцию зубов) или кровотечение в прошлом?
-В в этом случае какой вид ант и-гемофильного препарата был использован до сих пор, какой режим, что было эффективным и что имело аллергическую реакцию.
-В случае кровотечения, даты кровотечения, его интенсивности, ситуации, когда произошло кровотечение, наличие или отсутствие текущего бол и-синдрома.
Визуальные обследования при гематопоэтических или крови заболевают последовательно на коже. В частности, необходимо уделять заботу о существовании гематомы и геморральной опухоли. Гемартрозы характеризуются большим объемом сустава, чем симметричный сустав, и ограниченным движением сустава.
Это в случае гематоза или гематомы? Пальпация мягких тканей вокруг пораженного сустава (поверхность, плотность, боль, давление и мышечное натяжение, локальная оценка тепла). Кровавые пути характеризуются сложными и болезненными комками суставов, и большинство из них являются местной высокой температурой.
При гематоме оцениваются размер, твердость и признаки давления на окружающие органы и ткани.
Тест на сустав x-Ray: при гематозе выполняется для изучения органических изменений в структуре кости суставов и наличия суставочных жидкостей.
Перитонеальный ультразвуковой тест, тест на изображение брюшной полости: чтобы оценить размер и положение задней перитонеальной гематомы, признаки сжатия живота и таза выполняются для всех пациентов с задней перитонеальной гематомой.
Адаптация специалистов (для всех пациентов с клиническими симптомами).
-Хирург: клетки крови с расстройством подвижности суставов подозреваются.
-Задняя перитонеальная ультрасонография и диагноз изображений брюшной полости и таза.
Дифференциальный диагноз
Лечение
Цель лечения: он останавливает кровотечение на ранней стадии и предотвращает повреждение мягких тканей и большого количества снижения клеток крови.
Лечение наркотиков (регистрация ROK, курс / ежедневная доза, отсутствие препарата) Требуется тяжелая гемофилия, лечение кровотечения после травмы и экстракции зубов. Коэффициент коагуляции вводится три раза в неделю для гемофилии А (фактор VIII), а гемофилия B (фактор IX) вводится два раза в неделю, от 25 до 40 до 40 кг веса пациента.
2. Аварийный: -Все локальное кровотечение (подкожное, мышцы, задний брюшины, пищеварительная трубка, кровоизлияние головного мозга).
Амбулаторное лечение также обеспечивает генетическое консультирование для предотвращения идентификации пациентов, диагностики, лечения и последующих последствий для предотвращения нового начала их семей.
Лечение осложнений гемофилии в сп а-салоне, возникновение инвалидности может быть значительно остановлено и иногда предотвращено (уровень доказательств: b). Конкретные методы лечения должны назначаться внутренним врачом крови и физиотерапевтом. В некоторых случаях физиотерапия может быть скрыта гемостазом. Для укрепления мышечной системы, физиотерапия, массаж, плавание и т. Д. Применяются.
Лечение на дому: пациенты с тяжелой и умеренной гематомотомией и гематомотомией ингиобитора распознают начальные симптомы кровотечения после тренировки и наведения специалистом по крови и уже разработали необходимое количество фактора коагуляции дома. Вы сможете вводить ант и-в -Биточная подготовка, чтобы остановить кровотечение.
Поскольку время от кровотечения до лечения значительно снижается, чрезвычайно важное лечение на дому является наиболее эффективным для пациентов с гемофилией (уровень доказательств: а). При лечении на дому как период лечения, так и доза антигематомических препаратов снижаются. Значительно улучшить качество жизни пациента (качество жизни).
В качестве профилактического лечения обогащение фактора коагуляции вводится внутривенно для предотвращения кровотечения.
Цель профилактики: перевести тяжелую форму гемофилии в среднетяжелую, достигнув минимального уровня дефицитного фактора >2%, а в некоторых случаях и в легкую — > Это предотвращает суставы гемофилии, снижает частоту обострения и риск тяжелых осложнений (уровень доказательств: а). Этот препарат вводится три раза в неделю для гемофилии А и два раза в неделю для гемофилии В, с процентом от 25-40 до кг веса пациента.
Период профилактического лечения зависит от необходимости защиты кровотечения и поддержания хорошего функционального статуса, и, как говорят, требуется на протяжении всей жизни в течение нескольких месяцев.
Гемофилия
Болезнь гематомо является наследственным заболеванием гемостатической системы, основанной на снижении или инвалидности факторов VIII, IX и XI. Специфическими симптомами дружелюбия гематомота являются различные тенденции кровотечения: гематоз, внутриатальная гематома, гематурия, желудочн о-кишечное кровоизлияние, хирургическое вмешательство и длительное кровотечение при повреждении. В диагностике гематомотизма, генетического консультирования, активности факторов коагуляции, тестирования ДНК и анализа коагуляции являются наиболее важными. Лечение гемофилии обеспечивается альтернативной терапией, такой как переливание крови тромбоцитов, свежие замороженные корневища и ант и-хорош крови глобулин, включая коагуляционные факторы VIII или факторы IX.
Общие сведения
Болезнь гематомо — это заболевание, которое характеризуется сильной тенденцией кровотечения, вызванной дефицитом факторов коагуляции в плазме. Соотношение гемофилии A и B составляет один из 10 000 до 5000 человек. Во многих случаях болезнь гематомии в детстве является чрезвычайной задачей для педиатрии и педиатрии, потому что она развивается в детстве. В дополнение к гемофилии, в ее педиатрии, наследственные заболевания кровоизлияния, такие как геморрагические капилляры, снижение тромбоцитов и болезнь Гранцмана, обнаружены у детей.
Причины гемофилии
Поскольку ген, который вызывает гематомию, связан с Х-хромосомой, это заболевание является женщиной у женщины. Гемофилия наследования — это почти только мужская болезнь. Женщина является лидером гена гематомотлин (снопоставление, носитель) и рассказывает некоторым из ее сына болезнь.
Вероятность здорового мужского и женского дирижера рожает больного сына и здорового сына. Когда мужчина с гемофилией и здоровой женщиной выйдет замуж, рождаются здоровый сын и дочь. Пример гемофилии произошел у девушки, родившейся между матерью носителя и отцом пациента с гемофилией, является изолированным случаем.
Врожденная гемофилия встречается почти у 70 % пациентов. В этом случае форма и тяжесть гемофилии унаследованы. Приблизительно 30 % случаев представляют собой спорадическую гемофилию, вызванную мутациями в генах, которые кодируют синтез факторов свертывания плазмы на x хромосому. Эта спорадическая гемофилия позже становится наследственной гемофилией.
Коагуляция крови, то есть гемостаз, является наиболее важной реакцией для защиты вашего тела. Активация гемостатической системы происходит, когда кровеносные сосуды повреждены и начинается кровотечение. Коагуляция крови выполняется плазменным фактором, тромбоцитом и специальным веществом. Если один из факторов коагуляции недостаточен, своевременное кровотечение не будет возможно. При гемофилии образование тромббопластина, первая стадия коагуляции крови, нарушено и з-за дефицита факторов VIII и IX. В результате время коагуляции может быть длиннее, а кровотечение может не остановиться в течение нескольких часов.
Классификация гемофилии
Гемофилия отличается от (классического), B (Рождество), C и т. Д. И з-за дефицита одного из факторов коагуляции.
- Классическая гемофилия составляет большинство (около 85 %) этого заболевания, и образование активной тромбоциназы было нарушено и з-за отсутствия коагуляционного фактора VIII (антигемофильный глобулин).
- В гемофилии B, на которой приходится 13 %, существует потеря фактора IX (фактор Cristmas в плазме, фактор Cristmas), который также участвует в формировании активного типа тромбуциназы II фазы фракции.
- Частота гемофилии C-типа составляет 1-2 %, вызывая дефицит фактора коагуляции крови (предшественник тромббопластина). Другая гемофилия составляет менее 0,5 %, и существуют различные плазменные факторы: V (Parahemofilia), VII (гипопроконвернемия) и X (болезнь Стюарта-Провора).
Тяжесть клинического курса гематомотелев зависит от степени недостаточной активности коагуляции в факторах коагуляции в плазме.
- При тяжелой гемофилии уровень факторов дефицита составляет до 1 %, что сопровождается синдромом тяжелого кровотечения в детстве. Тяжелая гемофилия, которые дети часто вызывают естественное кровотечение и посл е-травматическое кровотечение в мышцах, суставах и внутренних органах. Сразу после рождения гематома черепа, длительное кровоизлияние пуповины, Мелена, а затем длительное кровотечение и з-за роста зубов и роста молочных зубов.
- Для детей гемофилии концентрация фактора в плазме составляет от 1 до 5 %. Он развивается в эпоху д о-школы, с синдромом умеренного кровотечения, с мышечным и суставным кровотечением и гематурией. Чрезвычайный происходит 2-3 раза в год.
- Мягкая гемофилия характеризуется фактором 5 % или более. Дебютировал в школьном возрасте и часто развивается и з-за травм и хирургии. Частота и степень кровотечения небольшие.
Симптомы гемофилии
У новорожденного признак гемофилии может включать длительное кровотечение, подкожную гематому и гематому черепа из пуповины. Кровь у детей в возрасте одного года может быть связано с зубами и хирургической хирургией (наряд надпочечников, процент). В зависимости от резкой части молочных зубов, язык, губы и щеки могут разжевывать или кровоточить из слизистой оболочки полости рта. Однако гемофилия редко ослабляется, потому что она содержит достаточно активной троромбохиназы в грудном молоке.
Когда ребенок с гемофилией встает и начинает ходить, возможность кровотечения после травмы довольно высока. У детей после одного возраста кровотечение носа, подкожное, взаимозаменяемое гематому и большие кровотечения распространены. После острых респираторных вирусных инфекций, ветряной оспы, краснухи, кори, гриппа и т. Д., Происходимым кровотечения возникают и з-за уменьшения кровеносных сосудов. В этом случае часто генерируется кровотечение DiApedis. Дети с гемофилией вызывают различную тяжелую анемию и з-за устойчивого и длительного кровотечения.
Гематома (70-80 %), гематома (10-20 %), гематома (14-20 %), желудочно-кишечное кровотечение (8 %), кровотечение в центральной нервной системе (5 %). Его можно разделить.
Гемофилия является наиболее частым и специфическим симптомом гемофилии. Первое и з-за кровотечения у детей у детей происходит после синяков, травмы или, естественно, когда им от 1 до 8 лет. В крови, боль, увеличение размера сустава, гипергликемии и высокая температура кожи над суставами. Повторяющийся плечевой сущерт вызывает хронический фильм, деформированный остеоартритит и контрактуру. Деформационный остеоартрит вызывает общие мышечные нарушени я-системы (кривизна позвоночника / таза, мышечная слабость, остеопороз и вальгус ног и т. Д.) И уже в детстве.
Гемофилия часто вызывает кровотечение в подкожных тканях и мышцах, которые представляют собой мягкие ткани. У детей устойчивые синяки наблюдаются в туловище и конечностях, часто вызывая глубокую мышечную гематому. Их легко распространять, потому что накопленная кровь не затвердевает, проникает вдоль фасции и проникает в ткань. Широкая и сильная гематома может сжимать основные артерии и периферические стволы, вызывая сильную боль, паралич, мускулистые науки и гангрена.
Гемофилия обычно вызывает кровотечение из десен, носа, почек и желудочно-кишечного тракта. Кровотечение может быть спровоцировано любой медицинской процедурой (внутримышечная инъекция, удаление зуба, тонзиллэктомия и др.). Кровотечение из глотки или носоглотки может быть очень опасным для детей с гемофилией и может вызвать обструкцию дыхательных путей, требующую экстренной трахеостомии. Кровоизлияние в мозговые оболочки и головной мозг может привести к серьезному повреждению центральной нервной системы и смерти.
Гемофильная гематурия может возникнуть спонтанно или в результате травмы поясничного отдела позвоночника. Может возникнуть дизурия, в мочевыводящих путях могут образоваться тромбы, возникнуть почечная колика. Пиелоэктазия, гидронефроз и пиелонефрит часто встречаются у больных гемофилией.
Желудочно-кишечные кровотечения у больных гемофилией могут быть связаны с приемом НПВП, обострением латентных язв желудка/двенадцатиперстной кишки, эрозивным гастритом и геморроем. Кровотечение из брыжейки или яичной оболочки проявляется острым животом и требует дифференциальной диагностики с острым аппендицитом или кишечной непроходимостью.
Гемофилия характеризуется отсроченным кровотечением, которое обычно возникает не сразу после травмы, а через некоторое время, иногда через 6—12 часов и более.
Диагностика гемофилии
В диагностике гемофилии участвуют многие специалисты, в том числе неонатологи, педиатры, генетики и гематологи. При наличии осложнений основного заболевания проконсультируйтесь с такими специалистами, как детский гастроэнтеролог, детский травматолог и ортопед, детский оториноларинголог, детский невролог.
Пары, подверженные риску рождения ребенка с гемофилией, должны получить генетическое консультирование на ранних стадиях планирования беременности. Носителей дефектного гена можно выявить с помощью анализа родословных и молекулярно-генетического тестирования. Пренатальная диагностика гемофилии возможна с помощью биопсии ворсин хориона или амниоцентеза и анализа ДНК клеточного материала.
После рождения диагноз гемофилии подтверждается гемостатическим тестом. Основные изменения коагулограммы при гемофилии включают увеличение времени свертывания крови, КУМ, тромбинового времени, МНО, времени повторной коагуляции и снижение ПТИ. При диагностике гемофилии крайне важно установить, что прокоагулянтная активность одного из факторов свертывания снижена ниже 50%.
При внутреннем кровотечении или забрюшинной гематоме — УЗИ органов брюшной полости и забрюшинного пространства, а при гематурии — анализ мочи и УЗИ почек.
Лечение гемофилии
Поскольку полностью излечить гемофилию невозможно, краеугольным камнем лечения является гемостатическая заместительная терапия концентратами факторов свертывания крови VIII и IX. Необходимое количество концентрата определяется тяжестью гемофилии, степенью и типом кровотечения.
Лечение гемофилии делится на две области, профилактическую и включенную, которая проводится в начале синдрома кровоизлияния. Введение предложения обогащения факторов коагуляции применяется к пациентам с тяжелой гемофилией и дв а-три раза в неделю для предотвращения гемофилии и других кровотечений. Если развивается синдром кровотечения, необходимо повторить переливание крови. Он также использует свежие замороженные корневища, эритромы и гемостаз. Все инвазивные вмешательства (отшивание, экстракция зубов и вся хирургия) у пациентов с гемофилией выполняются с гемостазом в качестве крышки.
Для легкой крови (порезы, кровотечения носа, кровотечение изо рта), гемостатическая губка, компрессионная повязка и раненые лечение тромбином являются эффективными. В случае кровотечения без осложнений необходимо полностью лечить отдых, охлаждение и пораженные суставы с помощью цыганов, а также необходимо лечить UHF, электрофорез, физиотерапия и легкий массаж. Пациенты с гематомией рекомендуются для витамина A, B, C, D, кальция и фосфора.
Прогноз и профилактика гемофилии
Длительная альтернативная терапия вызывает образование антител и составление антител, которые ингибируют содействие коагуляции коагуляции фактора, и гемостатическая терапия при нормальном количестве является недействительной. В таком случае пациентам с гемофилией назначается плазмафразис и иммунодепрессанты. Пациенты с гемофилией часто имеют переливание крови, и существует риск заражения ВИЧ, B, C, типом C, гепатитом D, герпесом и мегальями сайта.
Легкая гемофилия не влияет на прогноз жизни, но тяжелая гемофилия вызывает низкий прогноз и з-за хирургии и травмы.
Чтобы предотвратить это, медицинское генетическое консультирование проводится для пары с историей гемофилии. Дети с болезнью гематомии всегда должны иметь специальный паспорт, который указывает на тип заболевания, типа крови и отношения RH. Рекомендуется носить защитное оборудование, предотвратить травмы, наблюдение педиатрией, кровных ученых и педиатрических стоматологов и наблюдается в специальном центре гемофилии.
Гемофилия
Согласно статистике Всемирной организации здравоохранения (ВОЗ), у каждого из 5000 мальчиков развилась гемофилия. Это серьезное заболевание системы крови, и вы должны научиться жить с детства.
Причины болезни, классификация, у кого возникает
Наследственное заболевание, затронутое механизмом коагуляции крови. Пациенты часто кровоточили и з-за некоторых важных белков в крови.
Это заболевание классифицируется в зависимости от того, какой белок в крови является дефицитом.
- Гемофилия А, имеет классический вариант. Более 80 % пациентов имеют это. В этом случае отсутствующий фактор коагуляции является антигемофильным белком глобулина.
- Не такая большая, как гемофилия B 1 (только 13 % частоты заболеваемости). Фактором коагуляции, которого не хватает в гемофилии типа В, является тромббопластин.
- Гемофилия типа С: это очень редкая гемофилия, которую можно увидеть у детей 1-2 % или менее. Фактор, опередивший тромббопластин в крови, недостаточен.
Гемофилия наиболее часто встречается у мальчиков, если мать является носительницей патогенного гена с аномальной Х-хромосомой и передает его сыну. Отец может быть носителем гемофилии, но в этом случае носительство передается девочке, а не мальчику. Само заболевание проявляется только при одновременном поражении матери и отца ребенка. Известны также случаи мутаций (около 20%), при которых родители были здоровы, но ребенок родился больным гемофилией.

Тревожные симптомы и их выявление у детей
Дети в возрасте нескольких месяцев могут еще не проявлять никаких симптомов. Кровотечение из пуповины и гематомы встречаются редко. Клинические признаки становятся очевидными после первого года жизни.
- Когда приходит время прорезывания зубов, возникает сильное кровотечение.
- Ушибы и растяжения могут вызвать синяки. Они очень длинные, очень болезненные и медленно заживают.
Одним из характерных симптомов гемофилии являются носовые кровотечения неизвестной причины.
Опасность и осложнения болезни
Если кровотечение неконтролируемое и постоянное, оно может развиться.
- Гемартрозы (суставные кровотечения). Симптомы включают боль в суставах, отек, скованность, лихорадку и лихорадку.
- Паралич и гангрена Гематомы сильно сдавливают нервные окончания и крупные сосуды.
- Анемия У больных гемофилией может быть обильное кровотечение даже при незначительном медицинском вмешательстве, не говоря уже о серьезном хирургическом вмешательстве.
- Острая дыхательная недостаточность возникает, когда наблюдается ларингеальное кровотечение.
- Поражение центральной и периферической нервной системы. Причина: менингеальные кровоизлияния в области спинного или головного мозга.
Тяжелый некроз из-за костного кровоизлияния не является редкостью.
Постановка диагноза
Обычно это делается в два этапа. Во-первых, врачи тщательно собирают анамнез у родителей ребенка, чтобы выяснить, есть ли у кого-либо из родственников гемофилия. Затем необходимо проверить как саму кровь, так и плазму, чтобы увидеть, есть ли у пациента тромбы.
Существует ли способ вылечить гемофилию?
К сожалению, полного излечения от этого заболевания до сих пор не существует. Однако эффективная поддерживающая терапия может улучшить качество жизни детей. В медикаментозной терапии в основном лечат непрерывным вливанием компонентов свертывания крови, которых не хватает в детском организме. До недавнего времени его вводили каждый день, но последние разработки в области гематологии позволили сократить частоту введения до одного раза в три дня. Это делает жизнь пациента более комфортной.
В настоящее время эксперты тестируют другие методы лечения гемофилии в лаборатории. Основная цель – замена внутривенных инъекций пероральными таблетками. Существуют также гипотезы о возможности генной терапии. В случае успеха пациент может обходиться без инъекций в течение года.
Что делать родителям, если ребёнок болен гемофилией?
Гематолог или педиатр должны знать, как должны поступать родители, когда у их ребенка диагностировано это тяжелое заболевание. Все дети должны быть осмотрены педиатром, а родители должны быть осторожны, чтобы максимально предотвратить опасные травмы для своих детей.
Для ушибов и ран родители должны научиться применять губку гемостаза, лечение ран тромбином и как наносить сжатие повязки. Если такие меры необходимы, лечащий врач должен тщательно консультировать своих родителей.
Если вы серьезно пострадали, немедленно свяжитесь с врачом. Во многих случаях, когда симптомы исчезают, врачи назначают поддержку терапии, такую как UHF, электронное плавание, физиотерапия и нежная массажная терапия.
Также необходимо сообщить родителям о болезни ребенка.
- Доктор для лечения
- хирург
- Дантист
Прививки являются только подкожным введением пациентов с гемофилией. Мышечная инъекция всегда производит большие синяки, и ее трудно зачить.
Таким детям также нуждается в общенациональной еде. Желательно, чтобы все группы витаминов, фосфора и кальция существовали. Расскажите детям старшего возраста, как всегда, есть специальные документы, такие как паспорта. Он содержит всю необходимую информацию, такую как болезнь, диагноз, тип крови и фактор RH.
Сохранение психологического здоровья детей при гемофилии
Знакомство с этой болезнью — большая ответственность за родителей и детей, которые начали расти. Болезнь гематомо является длительной болезнью и часто получает физические и умственные ограничения. Как физическое ограничение, я не могу перемещать свое тело или играть со своими друзьями, и в своих психических и эмоциональных областях я всегда испытываю беспокойство и страдаю от неспособности выйти из этой ситуации.
Во многих случаях дети (особенно молодые люди «трудного года») пытаются отрицать свое состояние, отказываясь от постоянных инфузионных инъекций наркотиков, которые спасают жизни. В моем случае важно объяснить, что лечение необходимо. Если у вас есть четкая позитивная тенденция, дети и молодежь могут подумать, что лечение больше не требуется. Гемофилия является опасной и коварной болезнью, и, к сожалению, вы должны встречаться на всю жизнь, поэтому необходимо признать, что она не будет работать в случае гемофилии. Тем не менее, необходимо сказать пациенту, что результаты современной медицины смогли жить почти так же, как люди одного поколения. Единственное условие — обратить внимание на постоянное удаление волос.
Даже если вы следуете всем инструкциям вашего врача, лекарство может быть не эффективным, как и ожидалось. Тем не менее, боль и кровотечение интенсивны, поэтому дети, молодежь и их родители обычно отчаянно. Тем не менее, врачи должны объяснить, что нет возможности остановить лечение, так как лечение останавливается, как только лечение вызовет серьезные осложнения, которые угрожают жизни. Наиболее распространенными осложнениями являются остеоартрит бактерий гемофила.
Если эффект не является эффективным, вам необходимо, чтобы ваш врач консультировался и проконсультировался, и изменил его на препарат, который, как можно ожидать, будет эффективным в соответствии с случаем пациента. Например, у пациентов с гемофилией типа уже уже развилась новая подкожная инъекция. Это нефакторная терапия и уже достигла результатов.
Конечно, когда вы станете подростком, вы почувствуете чт о-то «дефект» и хотите быть таким же здоровым и нормальным, как люди одного поколения. Пациенту никогда не разрешается отказываться от лечения, и родителям необходимо обратить внимание на поведение пациента и наблюдать за процессом лечения.
Люди с гемофилией могут нуждаться в психологической помощи. Это обеспечивается квалифицированными психологами и психотерапевтами. Важно понимать, что для детей и молодых людей важно принимать и получать лечение.
























