В древние времена считалось, что боль — это гнев богов. Только Гиппократ впервые определил боль как одно из проявлений заболевания. Именно боль является наиболее ранним признаком многих патологических процессов, а ее локализация и характер помогают в диагностическом поиске. Как известно, значительная часть обращений пациентов к врачам всех специальностей связана именно с жалобами на болевые ощущения различной локализации, причем боль в глотке является наиболее частой причиной посещения лечебных учреждений и обращения населения в аптеки для приобретения лекарственных препаратов. В среднем каждый взрослый человек испытывает фарингеальную боль примерно 2–3 раза в год, в детском возрасте данные жалобы встречаются несколько чаще — до 8–10 раз в течение того же периода [1–3].
В настоящее время понятие «боль в горле» подразумевает большой спектр патологических состояний и используется для определения любых болевых ощущений в задней части ротовой полости или ротоглотке [3, 4]. Боль в глотке может быть разнообразной по характеру: различают острую, режущую, колющую, тупую, давящую, смешанную, локализованную, разлитую, мигрирующую и другие виды фарингалгии. Чувство боли может усиливаться при глотании, быть постоянным, приступообразным, стихающим, нарастающим. Высокая частота и значительная выраженность болевых ощущений данной локализации обусловлены богатой иннервацией слизистой оболочки ротоглотки и гортаноглотки. Чувствительная, двигательная и вегетативная иннервация осуществляется посредством глоточного сплетения, образованного ветвями языкоглоточного и блуждающего нервов, а также симпатическими волокнами верхнего шейного ганглия, имеющего в области устьев слуховых труб связи со второй ветвью тройничного нерва.
Особенности иннервации фарингеальной трубки обеспечивают «маскировку» целого ряда патологических процессов иной локализации болевыми ощущениями в горле. Иррадиация боли в глотку наблюдается при инородных телах пищевода и начальных отделов респираторного тракта; воспалительных заболеваниях гортани, заболеваниях уха, фаринголарингеальном и гастроэзофагеальном рефлюксах, заболеваниях щитовидной железы, сердечной патологии, невралгии языкоглоточного нерва; шилоподъязычном синдроме (синдром Игла), различных соматалгиях и симпаталгиях [5].
Тем не менее, наиболее часто боль в глотке обусловлена острыми воспалительными заболеваниями (тонзиллофарингиты различной этиологии и их регионарные осложнения) и хроническими воспалительными процессами структур лимфоидной ткани и задней стенки глотки [3, 6]. В подслизистом слое глотки имеется достаточно большой объем лимфоидной ткани — лимфоэпителиальное кольцо Вальдейера–Пирогова, что определяет предрасположенность к развитию инфекционно-воспалительных процессов, а функционально-анатомические особенности данного органа — к различным воздействиям неблагоприятных факторов и травмам. Очень важное место в структуре воспалительных заболеваний глотки занимает патология лимфоэпителиального глоточного кольца, центральное рабочее звено которого представлено небными миндалинами. Хронический тонзиллит является самым распространенным заболеванием из всех возможных патологических процессов лимфоидной ткани глотки [3, 4, 7]. Однако проблема хронического тонзиллита остается особенно актуальной не только ввиду его значительной распространенности среди детей и наиболее работоспособной части взрослого населения земного шара, но и благодаря высокому риску развития многочисленных осложнений. Основной функцией миндалин, как известно, является участие в формировании местного и общего иммунитета — миндалины постоянно контактируют с проникающими в организм антигенами и благодаря своему анатомическому и морфологическому строению обеспечивают продукцию интерферонов, интерлейкинов, иммуноглобулинов и других биологически активных веществ. Воспаление — неотъемлемая часть функционального состояния миндаликовой ткани. При развитии хронического процесса воспалительные реакции в миндалинах имеют более выраженный характер и развиваются в глубже расположенных отделах миндаликовой ткани, включая лимфатическую и кровеносную сосудистую сеть. Доказано, что начало и последующее развитие тонзиллита зависит не только от состояния иммунитета, но в большей степени от инфекционных факторов, как отдельных видов микроорганизмов, так и их ассоциаций [3, 7].
Адекватная диагностика и рациональное эффективное лечение заболеваний глотки — актуальная проблема практического здравоохранения. Одними из главных задач лечения больных с патологией глотки являются нормализация фарингоскопической картины и купирование местных неприятных ощущений. Соответственно терапевтические методы направлены на элиминацию этиотропного фактора, уменьшение воспалительных изменений и устранение симптомов заболевания. Основным инфекционным фактором развития острых воспалительных изменений в глотке являются вирусные агенты. К сожалению, в Европе и Российской Федерации уже при первом обращении с жалобами на боль в глотке в 70% клинических случаев медицинские работники назначают больным системные антибактериальные средства. На фоне часто необоснованного и нерационального применения системных антимикробных препаратов в последние годы отмечается увеличение количества антибиотико-резистентных штаммов бактериальной флоры, которая может служить этиотропным фактором развития целого ряда инфекционных процессов, в первую очередь в ЛОР-органах и нижерасположенных отделах респираторного тракта. Назначение системных антибиотиков должно быть клинически оправданным и ограничено строгими медицинскими показаниями [8]. Системное этиотропное лечение во всех случаях показано только больным острым стрептококковым тонзиллофарингитом. При боли в горле также не рекомендуется рутинно применять системные нестероидные противовоспалительные средства в связи с высоким риском развития побочных эффектов — реакций гиперчувствительности, ульцерогенного действия, нефропатий и ряда других. Использование же более безопасных современных селективных нестероидных противовоспалительных средств, ингибирующих преимущественно циклооксигеназу-2, является нецелесообразным в связи с замедленным противовоспалительным эффектом в сравнении с «классическими» препаратами.
Таким образом, основным методом лечения заболеваний глотки является применение топических лекарственных средств. Основными преимуществами местной терапии являются создание оптимальной концентрации препарата в области патологического очага и отсутствие системного действия. Большинство лекарственных средств, выпускаемых для лечения острых воспалительных заболеваний глотки, относится к группе безрецептурного отпуска и применяется пациентами самостоятельно, без согласования с врачом. Но и специалистам зачастую бывает трудно ориентироваться в огромном количестве препаратов для купирования боли в глотке. Симптоматическая терапия заключается в назначении анальгезирующих и местно-анестезирующих препаратов. Местные лекарственные формы анестетиков и обезболивающих препаратов призваны избежать системного действия нестероидных противовоспалительных средств, обеспечивая непосредственный контакт лекарства со слизистой оболочкой рта и глотки [9]. Препараты для местного лечения должны не только купировать основные симптомы острого и обострения хронических фарингеальных воспалительных процессов, но и обладать широким спектром антимикробного действия, низкой аллергенностью, отсутствием токсичности и раздражающего действия на слизистую оболочку. Местное лечение предполагает назначение препаратов, обладающих антисептическим, противовоспалительным и обезболивающим действиями [6]. В состав местных лекарственных форм обычно входит один или несколько антисептиков (хлоргексидин, гексетидин, бензидамин, амбазон, тимол и его производные, спирты, препараты йода), нестероидные противовоспалительные средства, эфирные масла, местные анестетики (лидокаин, тетракаин, ментол), реже — антибиотики (фузафунгин, фрамицетин, грамицидин С) или сульфаниламиды. Препараты также могут содержать лизаты бактерий, природные антисептики (экстракты растений, продукты пчеловодства), синтезированные факторы неспецифической защиты слизистых оболочек, обладающие еще и противовирусным действием (лизоцим, интерферон, лактоферрин), витамины (аскорбиновая кислота) и некоторые другие компоненты [2].
Новым, клинически обоснованным патогенетическим лечением боли в глотке с высоким профилем безопасности является использование препарата Стрепсилс® Интенсив, обладающего выраженным противовоспалительным и анальгезирующим свойствами. Стрепсилс® Интенсив выпускается в форме таблеток для рассасывания и содержит низкие дозы активного компонента — флурбипрофена. Механизм действия флурбипрофена связан с ингибированием фермента циклооксигеназа и угнетением синтеза простагландинов — медиаторов воспаления, обусловливающих развитие отека, боли, гиперемии и функциональных нарушений. В сутки, согласно инструкции по применению, можно использовать не более 5 таблеток. Стрепсилс® Интенсив необходимо медленно рассасывать, интервал между приемами составляет 2–3 часа. Не следует принимать данное средство более 3 дней. Флурбипрофен как противовоспалительное и обезболивающее средство наиболее мягко действует на пораженную слизистую оболочку глотки. Пациент чувствует дополнительное облегчение из-за эффекта физического обволакивания горла. К тому же требуемая доза активного вещества, принимаемого с местными анальгетиками, ниже, чем при приеме системных анальгетиков, а эффект наступает достаточно быстро [10]. Флурбипрофен относится к хорошо изученным нестероидным противовоспалительным средствам, его эффективность и достаточная безопасность были доказаны не только в клинических исследованиях, но и результатами многолетнего применения в практике при различных патологических состояниях [4, 10, 11]. Национальные и международные данные мониторинга безопасности Стрепсилс® Интенсив позволили перевести препарат в группу безрецептурных средств [9]. Данное лекарственное средство оказывает мощное противовоспалительное и обезболивающее действие, на фоне хорошей переносимости демонстрирует высокую клиническую эффективность: терапевтический эффект наступает в течение 15 мин после приема первой дозы и длится не менее 2–3 часов. Выраженное стойкое уменьшение симптоматики — боли и воспалительных изменений в глотке — достигается уже на 2–3 день лечения [12, 15]. Препарат снижает отечность слизистой оболочки глотки на срок до 4–6 ч, что значительно облегчает затрудненное глотание, и способен быстро подавлять воспалительный процесс, возникший в результате действия как вирусов, так и бактерий [12].
С целью оценки эффективности и безопасности использования препарата Стрепсилс® Интенсив у пациентов после тонзиллэктомии, было проведено простое сравнительное неинтервенционное наблюдательное исследование на базе кафедры и клиники болезней уха, горла и носа Первого МГМУ им. И. М. Сеченова. В ходе исследования наблюдалось 60 пациентов в возрасте от 18 до 47 лет с хроническим тонзиллитом, которым по показаниям в плановом порядке была выполнена двусторонняя тонзилэктомия. Проводился анализ субъективных жалоб — боли в глотке, ощущения затруднения при глотании, неприятного привкуса во рту, ощущения отека, дискомфорта и першения в глотке, общего недомогания; оценка объективной картины — перифокальных гиперемии и отека слизистой оболочки глотки, выраженности и цвета фибринозного налета в нишах и учет частоты использования системных обезболивающих препаратов (Кетонала). Результаты проведенного наблюдательного исследования продемонстрировали, что добавление в схему ведения пациентов после тонзиллэктомии препарата Стрепсилс® Интенсив приводит к уменьшению степени выраженности реактивных воспалительных изменений и болевых ощущений, что обеспечивает улучшение качества жизни и ускорение процессов заживления.
Заслуживает внимания и еще один препарат в линейке местных форм — Стрепсилс® — комбинированное антибактериальное и фунгицидное лекарственное средство для применения в стоматологии и ЛОР-практике. Благодаря сочетанию в препарате двух действующих веществ — амилметакрезола (600 мкг) и 2,4-дихлорбензилового спирта (1,2 мг) — достигнута его высокая антимикробная активность. Амилметакрезол разрушает собственно оболочку микроорганизма, 2,4-дихлорбензиловый спирт вызывает дегидратацию биологического объекта. Стрепсилс® обладает антисептическим, противомикробным и антимикотическим действием, активен в отношении широкого спектра грамположительных и грамотрицательных микроорганизмов, вызывающих заболевания глотки, в том числе в отношении большинства стафилококков, стрептококков групп А, С и D, Diplococcus pneumoniae, Pseudomonas aerugenosa, Klebsiella aerogenes, Haemophilus influenzae, Proteus spp., Aerobacter aerogenes, Aerobacter cloacae и других, а также дрожжеподобных грибов Candida albicans [14]. Экспериментально in vitro была продемонстрирована активность амилметакрезола и 2,4-дихлорбензилового спирта по отношению к штаммам респираторного синцитиального вируса (RSV), вируса гриппа (тип А), вируса атипичной пневмонии (SARS-CoV) [5]. Наличие в составе Стрепсилс® вспомогательных веществ — эфирных масел, эвкалипта, меда, лимона, трав, ментола и других — способствует устранению раздражения в глотке и полости рта, снижает боль, ощущение инородного тела, першения, саднения и дискомфорта в глотке. Компоненты препарата обладают низкой адсорбцией, в связи с чем отсутствует системный эффект — токсическая доза для человека превышает терапевтическую в 70 тысяч раз. Выпускается и специальная лекарственная форма — Стрепсилс® для детей с 6 лет со вкусом лимона [13].
Подводя итог вышеизложенному, рациональная местная терапия является наиболее эффективным и безопасным способом лечения воспалительных заболеваний глотки. Клинический успех и хорошая переносимость позволяют рекомендовать широкое использование топических лекарственных средств, в том числе Стрепсилс® Интенсив и Стрепсилс® в качестве препаратов выбора в лечении фарингеальной патологии различного генеза.
Литература
- Арефьева Н. А. Тонзиллярная патология. Современное состояние проблемы // Вестник оториноларингологии. 2012. № 6. С. 10–13.
- Полунина Т. А. Лечение боли в горле у детей // Практика педиатра. 2011. октябрь. С. 59–61.
- Пальчун В. Т., Лучихин Л. А., Крюков А. И. Воспалительные заболевания глотки. Руководство для врачей. М.: ГЭОТАР-Медиа. 2007. 288 с.
- Blagden M., Christian J., Miller K., Charlesworth A. Multidose flurbiprofen 8,75 mg lozenges in the treatment of sore throat: a randomised, double-blind, placebo-controlled study in UK general practice centres // Int J Clin Pract. 2002; 56 (2): 95–106.
- Gwaltney J. M. In: Mandell G. L, Bennet J. E., Dolin R. eds. Principles and practice of infectious diseases. New York, 1995.
- Полякова Т. С., Гуров А. В., Поливода А. М. Современный взгляд на проблему терапии тонзиллофарингитов // РМЖ, 2007, т. 15, № 2, с. 146–150.
- Пономарев Л. Е., Шубич М. Г. Актуальные вопросы тонзиллярной иммунологии // Новости оториноларингологии и логопатологии. 1998. № 2, с. 105–110.
- Страчунский Л. С., Каманин Е. И. Антибактериальная терапия инфекций в оториноларингологии // РМЖ. 1997. Т. 6. № 11. С. 684–693.
- Сединкин А. А., Баландин А. В., Димова А. Д. Результаты открытого проспективного контролируемого рандомизированного сравнительного исследования эффективности и переносимости флурбипрофена и парацетамола у пациентов с болью в горле // Тер. архив. 2005. № 77 (3). С. 74–76.
- Gibb I. A. и др. Research Report TH9903 — A pharmacy-based post-marketing population risk trial of flurbiprofen 8.76 mg lozenges in subjects with sore throat. Boots Healthcare International. Veltri J., 2000.
- Watson N., Mimmo W. S., Christian J. et al. Relief of sore throat with the anti-inflammatory throat lozenge flurbiprofen 8,75 mg: a randomised, double blind, placebo controlled study of efficacy and safety // Int J. Clin Pract. 2000; 54 (8): 490–496.
- Christian J., Largey P. M., Shaw H. et al. Local and general tolerability of flurbiprofen lozenges in healthy volunteers/Poster presented at XXIX National Congress of the Italian Society of Pharmacology. Florence, Italy, 20–23 June 1999.).
- www.strepsils.ru. Инструкция по применению препарата Стрепсилс.
- RSV, SARS-assoziiertes Coronavirus, Influenza-A-Virus. A throat lozenge containing amylmetacresol and dichlorobenzyl alcohol has a direct virucidal effect on respiratory syncytial virus, influenza A and SARS-CoV // Antivir. Chem. & Chemother. 2005; 16: 129–134.
- Свистушкин В. М., Никифорова Г. Н. и соавт. Оптимизация послеоперационного периода у больных хроническим тонзиллитом // РМЖ, № 6, 2015.
Г. Н. Никифорова1, доктор медицинских наук, профессор
В. М. Свистушкин, доктор медицинских наук, профессор
М. Г. Дедова
Д. М. Пшонкина
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
1 Контактная информация: gn_nik_63@mail.ru
Острый тонзиллит и фарингит
Также:
Острый тонзиллофарингит
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Острый тонзиллит (J03), Острый фарингит (J02)
Разделы медицины:
Оториноларингология, Оториноларингология детская
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Национальная медицинская ассоциация оториноларингологов
- Межрегиональная общественная организация «Альянс клинических химиотерапевтов и микробиологов»
- Союз педиатров России
- Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
- Международная общественная организация «Евро-Азиатское общество по инфекционным болезням»
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Острый тонзиллит и фарингит (Острый тонзиллофарингит)
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые,Дети
Год окончания действия: 2023
ID:306
Определение заболевания или состояния (группы заболеваний или состояний)
Острый тонзиллофарингит – острое инфекционное воспаление слизистой оболочки и лимфатических структур ротоглотки (небные миндалины, лимфоидные фолликулы задней стенки глотки). Сам термин ОТФ является объединяющим для острого воспаления небных миндалин (острый тонзиллит) и острого воспаления задней и боковой стенок глотки (острый фарингит), однако в подавляющем большинстве случаев, особенно при вирусной этиологии процесса, имеет место воспаление обеих локализаций (за исключением фарингита у пациента, перенесшего тонзиллэктомию) [1].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
J02 – Острый фарингит
J02.0 – Стрептококковый фарингит
J02.8 – Острый фарингит, вызванный другими уточненными возбудителями
J02.9 – Острый фарингит неуточненный
J03.0 – Стрептококковый тонзиллит
J03.8 – Острый тонзиллит, вызванный другими уточненными возбудителями
J03.9 – Острый тонзиллит неуточненный
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
По локализации: острый тонзиллит, острый фарингит, острый тонзиллофарингит (постановка и кодировка диагноза может базироваться на определении преобладания выраженности воспаления того или иного отдела ротоглотки).
По этиологии: стрептококковый, нестрептококковый (или вирусный). При этом этиологическая диагностика заболевания имеет первостепенное значение в плане выбора тактики лечения и дальнейшего ведения пациентов.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Наиболее частыми возбудителями ОТФ являются респираторные вирусы (аденовирус, вирус Эпшейна-Барр, вирус парагриппа, респираторно-синтициальный вирус, риновирус, бокавирус, метапневмовирус). Возможна роль энтеровирусов (Коксаки В) [2].
Среди бактериальных возбудителей первостепенное значение имеет бета-гемолитический стрептококк группы А (БГСА, или Streptococcus pyogenes).
Ряд авторов указывает на определенную роль других бактериальных возбудителей, таких как стрептококки групп С и G, Arcanоbacterium haemolyticum, и др. Выделение других микроорганизмов (Staphylococcus aureus, Streptococcus pneumoniae и др.) с задней стенки глотки/миндалин у пациентов с клиникой ОТФ расценивается как колонизация и не требует назначения АМТ.
Еще более редкие бактериальные возбудители острых тонзиллитов – спирохеты (ангина Симановского-Плаута-Венсана), анаэробы. Нельзя забывать, что острый тонзиллит является одним из возможных симптомов таких заболеваний, как дифтерия (Corynebacterium diphtheriae), гонорея (Neisseria gonorrhoeae) [3,4].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ОТФ относится к наиболее распространенным состояниям в амбулаторной практике у детей и взрослых. С БГСА связано от 5 до 15% случаев острых тонзиллофарингитов во взрослой популяции и 15-37% у детей [5,6,7,8,]. У детей до 3 лет ОТФ чаще всего имеет вирусную этиологию, при этом вероятность БГСА-тонзиллита в этом возрасте минимальная (3%). Наиболее высокий уровень заболеваемости ОТФ, вызванным БГСА, отмечается у детей в возрасте 5-15 лет [9]. У пациентов старше 45 лет вероятность стрептококковой этиологии становится минимальной [3,6]. Для ОТФ, вызванного БГСА, характерна сезонность (конец зимы — ранняя весна) [10].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Для ОТФ любой этиологии характерны:
- острое начало,
- фебрильная лихорадка (>38 C, реже ОТФ протекает с нормальной или субфебрильной температурой),
- дискомфорт и/или боль в горле, усиливающиеся при глотании, возможна иррадиация в ухо
- возможно двустороннее увеличение, болезненность регионарных лимфатических узлов
- в раннем детском возрасте возможен отказ от еды (от проглатывания любой пищи, даже жидкой)
- состояние удовлетворительное или средней тяжести.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ставится на основании патогномоничных данных: жалоб больного на выраженную боль в горле, усливающуюся при глотании, данных физикального обследования: гиперемии, инфильтрации, отечности небных миндалин, увеличении регинарных лимфатических узлов.
Жалобы и анамнез
Основными жалобами при ОТФ являются боль в горле, усиливающаяся при глотании, и лихорадка. При неосложненном течении, как правило, боль имеет симметричный характер. В раннем детском возрасте, при невозможности вербализовать или правильно описать болевые ощущения, обращает на себя внимание отказ ребенка от еды или от проглатывания пищи, предпочтение гомогенной или жидкой пищи.
Специфический анамнез, как правило, отсутствует, за исключением эпидемиологических данных об очаге острой стрептококковой инфекции (однако в последнее время вспышки острого стрептококкового тонзиллофарингита достаточно редки).
Физикальное обследование
При фарингоскопии — небные миндалины гиперемированы, инфильтрированы, отечны, возможно появление экссудата (налетов) белого, грязно-белого или желтого цвета, задняя стенка глотки гиперемирована, язычок (увуля) отечный. Миндалины, особенно у детей, могут увеличиваться в размерах. Увеличение миндалин при ОТФ носит симметричный характер, что позволяет дифференцировать ОТФ от паратонзиллярного абсцесса.
По клинической картине однозначно отдифференцировать вирусный и бактериальный ОТФ не представляется возможным.
Для ОТФ, вызванного БГСА, характерно увеличение подчелюстных и/или передне -шейных лимфатических узлов.. Для течения ОТФ, вызванного БГСА, характерна фебрильная лихорадка (редко БГСА-тонзиллофарингит протекает с субфебрильной или нормальной температурой тела), острая боль в горле, изменения при фарингоскопии (яркая гиперемия, «пылающий зев», наличие (в большинстве случаев) экссудата на миндалинах, отсутствие катаральных явлений.
Появление петехий на мягком небе возможно как при ОТФ, вызванном БГСА , так и ВЭБ. При этом при ВЭБ –инфекции петехии чаще располагаются на мягком небе.
Как правило, ОТФ вирусной этиологии сопровождается другими катаральными симптомами (ринит, конъюнктивит, кашель).
При ОТФ, вызванном ВЭБ, возможна генерализованная лимфоаденопатия, а также нередко гепатомегалия и спленомегалия, что может помочь при проведении дифференциального диагноза
Для дифференциальной диагностики вирусного и стрептококкового ОТФ по клинической картине несколькими практическими рекомендациями и руководствами рекомендуется использование шкал Центора или МакАйзека (Приложение Г1) [4,5]
McIsaac WJ, White D, Tannenbaum D, Low DE. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. Can Med Assoc J 1998; 158: 75–83]. Оценка по шкале Центора помогает идентифицировать пациентов, у которых высока вероятность БГСА-инфекции, однако не позволяет установить диагноз с абсолютной точностью[11,12,13].
Лабораторные диагностические исследования
- Рекомендуется проводить дифференциальную диагностику при ОТФ между стрептококковой и вирусной этиологией заболевания [1,14,15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется проведение экспресс-теста для выявления антигенов стрептококка группы А в мазке с задней стенки глотки у пациентов с клиникой ОТФ (Иммунохроматографическое экспресс-исследование мазка из зева на стрептококки группы А) [4,5,16,17].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии:
Экспресс-тестирование основано на методе иммуноферментного анализа или иммунохроматографии, предполагает получение результата «у постели больного» в течение 5-15 минут. Анализ не требует наличия специальной лаборатории. Средние специфичность и чувствительность современных тест-систем составляют 94 и 97%, соответственно.
При положительных результатах экспресс-теста нецелесообразно проводить культуральное исследование (Бактериологическое исследование отделяемого из зева на стрептококк группы A (Streptococcus gr. A) из-за высокой специфичности экспресс-диагностики БГСА-инфекции [5,16].
При отрицательных результатах экспресс-теста у взрослых пациентов нецелесообразно проводить культуральное исследование в связи с низкой частотой встречаемости БГСА-тонзиллофарингита и низким риском последующего развития ревматической лихорадки у данной категории пациентов [5]. Отрицательный результат экспресс-теста у детей и подростков с подозрением на ОТФ, вызванный БГСА, следует подтвердить культуральным исследованием (Бактериологическое исследование отделяемого из зева на стрептококк группы A (Streptococcus gr. A) [5].
Не следует рутинно проводить экспресс-тест (Иммунохроматографическое экспресс-исследование мазка из зева на стрептококки группы А) у детей до 3 лет из-за редкой встречаемости ОТФ, вызванного БГСА, в данной возрастной группе. Исключением является наличие факторов риска БГСА-тонзиллита у ребенка до 3 лет (например, заболевание старшего брата или сестры ОТФ, вызванным БГСА, т.е. соответствующее эпидемиологическое окружение) [5].
- Рекомендуется обследование на БГСА (культуральное исследование мазка с поверхности небных миндалин) (Бактериологическое исследование отделяемого из зева на стрептококк группы A (Streptococcus gr. A)) при невозможности проведения экспресс-диагностики (пациентам любого возраста) или при отрицательном результате экспресс-теста (детям) [5,18,19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Только клинические данные не являются надежными критериями в дифференциальной диагностике ОТФ, вызванного БГСА и вирусами, за исключением случаев, когда выражены специфические симптомы вирусной инфекции (ринит, кашель, охриплость и/или язвенные поражения слизистой оболочки полости рта, т.е. 0-1 балл по шкале Центора) – в этой ситуации проведение микробиологического исследования не показано.
Рутинное бактериологическое исследование не следует проводить у детей до 3 лет из-за редкой встречаемости ОТФ, вызванного БГСА, в данной возрастной группе. Исключением является наличие факторов риска БГСА-тонзиллофарингита у ребенка до 3 лет (например, заболевание старшего брата или сестры ОТФ, вызванным БГСА, т.е. соответствующее эпидемиологическое окружение) [5].
Чувствительность и специфичность микробиологического (культурального) исследования (Бактериологического исследования отделяемого из зева на стрептококк группы A (Streptococcus gr. A) при соблюдении всех условий забора материала, транспортировки и инкубации оцениваются как близкие к 100%. Недостатком культурального исследования является длительное время до получения результата.
Исследование мазка со слизистой оболочки ротоглотки на Corynebacterium diphtheriae (Микробиологическое (культуральное) исследование слизи и пленок с миндалин на палочку дифтерии (Corynebacterium diphtheriae)) пациентам с ОТФ проводится в соответствии с Постановлением Главного государственного санитарного врача РФ от 9 октября 2013 г. № 54 «Об утверждении СП 3.1.2.3109-13 «Профилактика дифтерии».
Подозрение на дифтерию основывается на совокупности данных эпидемиологического и вакцинального анамнезов, клинической симптоматики (в т. ч. отек мягких тканей шеи, стеноз гортани, однако нужно помнить о возможности дифтерии ротоглотки без иной характерной симптоматики) и фарингоскопической картины. В последние годы в Российской Федерации отмечается стабильно благоприятная эпидемиологическая обстановка в отношении заболеваемости дифтерией [20].
Рекомендуется проводить получение материала для бактериологического исследования или выполнения экспресс-теста при соблюдении следующих условий [5,21]:
— до начала антибактериальной терапии;
— до утреннего туалета полости рта, натощак или через 2 часа после еды;
— под контролем орофарингоскопии;
— следует избегать контакта с зубами и языком;
— материал получают из устьев крипт небных миндалин и задней стенки глотки.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: При несоблюдении описанных выше условий информативность диагностических методов снижается.
- Не рекомендуется рутинное исследование маркеров воспаления (С-реактивного белка, прокальцитонина) при ОТФ [4,5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Во многих отечественных и зарубежных работах была продемонстрирована крайне низкая информативность уровня маркеров воспаления (лейкоцитоз, нейтрофилез, «сдвиг влево», СОЭ, С-реактивный белок, прокальцитонин) [3, 7]. Несмотря на то, что высокий уровень маркеров воспаления несколько чаще отмечается при бактериальном ОТФ, он возможен и при вирусном происхождении воспаления, в то время как низкие их уровни ни в коем случае не исключают стрептококковую этиологию. Выяснение же этиологии заболевания является ведущим в определении тактики терапии.
- Не рекомендовано рутинное проведение общего (клинического) анализа крови развернутого, исследование может быть проведено при необходимости, в т.ч., при госпитализации в стационар и/или в рамках дифференциальной диагностики с инфекционным мононуклеозом [23,24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Не рекомендуется рутинное определение антистрептолизина-О в сыворотке крови при диагностике ОТФ, так как антитела появляются позднее и не являются свидетельством текущей инфекции [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Исследование уровня антистрептолизина-О (АСЛ-О) сыворотки крови является инструментом для ретроспективной диагностики, т.к. он повышается лишь на 7-9 день стрептококковой инфекции, а также может отражать ранее перенесенные заболевания или хроническую инфекцию [5,25].
Кроме того, АСЛ-О следует определять у пациентов с подозрением на осложнения, связанные с иммунопатологическими процессами, например, при постстрептококковом гломерулонефрите, ревматической лихорадке и PANDAS-синдроме (см. соответствующие клинические рекомендации).
- Не рекомендуется рутинное проведение контрольного обследования на БГСА (Бактериологическое исследование отделяемого из зева на стрептококк группы A (Streptococcus gr. A) и/или экспресс тест (Иммунохроматографическое экспресс-исследование мазка из зева на стрептококки группы А) для оценки излеченности при ОТФ, однако необходимость их проведения может быть рассмотрена в ряде случаев, в том числе, у пациентов с относительно высоким риском развития острой ревматической лихорадки или при наличии рецидивирующих симптомов, сходных с БГСА-ОТФ [4,5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Инструментальные диагностические исследования
Не требуются.
Иные диагностические исследования
Дифференциальная диагностика
- При дифференциальной диагностике вирусного и бактериального ОТФ рекомендуется обратить внимание на наличие катаральных явлений (насморк, кашель, охриплость), характерных для респираторной вирусной инфекции, протекающей с тонзиллофарингитом; такая картина наблюдается не более чем у 10% пациентов БГСА-тонзиллофарингитом (при наличии вирусной ко-инфекции) [14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: также с признаками ОТФ могут протекать следующие заболевания:
- Инфекционный мононуклеоз – вирусная инфекция, протекающая с клиникой ОТФ, чаще встречается у подростков и молодых взрослых (до 30 лет). Для инфекционного мононуклеоза также характерны слабость, лимфоаденопатия с вовлечением шейных и, нередко, и других групп лимфатических узлов, гепатоспленомегалия, характерные гематологические показатели (лимфоцитарный лейкоцитоз, появление широкоплазменных лимфоцитов – атипичных мононуклеаров) [26]. Обнаружение ДНК вируса Эпштейна-Барр в мазке с задней стенке глотки (слюне) и/или крови методом ПЦР и серологические методы (наличие IgM к капсидному антигенному комплексу вируса Эпштейна-Барр) позволяют установить диагноз инфекционного мононуклеоза.
- Энтеровирусный везикулярный стоматит (синдром рука-нога-рот, англ. Hand, foot and mouth disease) характерен для детей младшего возраста (до 5 лет), обычно возникает в летние месяцы и протекает с умеренно выраженной лихорадкой, везикулярными высыпаниями в ротовой полости при отсутствии налетов на миндалинах, а также экзантемой на руках и стопах.
- Ангина Симановского-Плаута-Венсана (возбудитель — Fusobacterium necrophorum) протекает с односторонним некротическим изъязвлением миндалины, иногда также неба и слизистой оболочки рта с характерным гнилостным запахом.
- Дифтерия зева, которая обусловливает плотный налет на миндалинах, снимающийся с трудом, оставляя кровоточащую поверхность.
- Синдром Маршалла или PFAPA (periodic fever, aphtous stomatitis, pharingitis, adenitis — периодическая лихорадка, афтозный стоматит, фарингит и шейный лимфаденит). Синдром Маршалла характеризуется волнообразным течением, приступ начинается с высокой лихорадки (до 39-40 ), сопровождающейся симптомами тонзиллита или фарингита (боль в горле, гиперемия миндалин), афтозного стоматита (язвы в полости рта) и увеличенными шейными лимфатическими узлами. Также могут наблюдаться боли в суставах, боли в животе, головные боли и симптомы общей интоксикации. Приступ длится несколько дней, рецидивы наблюдаются каждые 1-2 месяца. Возраст заболевших составляет, в среднем, 5 лет, и к 10 годам дети, как правило, выздоравливают, хотя у ряда пациентов симптомы сохраняются и во взрослом периоде. Лабораторно регистрируются лейкоцитоз, высокая СОЭ, а также повышение уровня СРБ. [27].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
- При вирусной инфекции антибактериальные препараты системного действия не рекомендованы. Системная антибактериальная терапия не эффективна в отношении вирусных тонзиллофарингитов и не предотвращает бактериальную суперинфекцию. [2,28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется назначать антибактериальные препараты системного действия только в случае доказанной бактериальной инфекции.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5) [4,5,18] или высоко вероятной стрептококковой этиологии ОТФ [2,4,5] Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- с учетом 100% чувствительности S.pyogenes к бета-лактамным антибактериальным препаратам: пенициллинам в качестве препарата выбора при БГСА-тонзиллитах рекомендуется антибактериальный препарат системного действия – Амоксициллин** (АТХ код: J01CA04) [5,29,30,31,32,33,34,35,36].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: Дозировки Амоксициллина** (АТХ код:J01CA04) — 500 мг х 2-3 раза в сутки у взрослых и 50 мг/кг/сут в 2 приема, но не более 1000 мг в сутки, внутрь у детей, в течение 10 дней
В настоящее время в качестве практически единственного показания к назначению антибактериальных препаратов системного действия у иммунокомпетентных лиц рассматривается БГСА-этиология ОТФ (за исключением крайне редких случаев дифтерии, гонококкового тонзиллита, язвенно-некротической ангины Симановского-Плаута-Венсана).
Целями назначения антибактериальных препаратов системного действия при остром стрептококковом тонзиллофарингите являются:
— эрадикация возбудителя (БГСА);
— профилактика осложнений («ранних» гнойных и «поздних» аутоиммунных);
— ограничение очага инфекции (снижение контагиозности);
— клиническое выздоровление.
Необходимо помнить, что при инфекционном мононуклеозе возможно развитие так называемой «ампицилиновой» или «амоксициллиновой» сыпи.
- Рекомендуется при рецидивирующем течении острых стрептококковых тонзиллофарингитов с целью преодоления механизмов, обуславливающих микробиологическую неэффективность предшествующего лечения, назначение амоксициллин+клавулановая кислота** (АТХ код: J01CR02) или клиндамицином** (Код ATX: J01FF01) 10 дней [5,32,36,37,38].
Уровни убедительности рекомендаций В (уровни достоверности доказательств – 2)
Комментарий:
при рецидивах ОТФ необходима консультация врача-оториноларинголога для подтверждения/исключения хронического тонзиллита, а в ряде случаев, особенно у детей, при наличии соответствующей клинической картины, провести дифференциальную диагностику с синдромом Маршалла (PFAPA).
Дозировки амоксициллин+клавулановая кислота** (АТХ код: J01CR02): взрослым и детям 12 лет и старше или с массой тела 40 кг и более в дозе 875/125 мг х 2 раза в день (для детей 40 мг/кг/сут по амоксициллину)
Дозировки клиндамицина** (Код ATX: J01FF01): взрослые и дети старше 12 лет: 600-1800 мг/сут внутрь в 2, 3 или 4 приема (равные дозы)
- Рекомендовано при отсутствии положительной динамики (сохранение лихорадки и болевого синдрома) в течение 48-72 часов от момента начала антибактериальной терапии пересмотреть диагноз (вероятное течение ОРВИ, инфекционного мононуклеоза), [5,14,31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- При наличии в анамнезе аллергической реакции (за исключением анафилаксии) на бета-лактамные антибактериальные препараты: пенициллины, рекомендуется применение цефалоспоринов 2-го поколения и цефалоспоринов 3-го поколения [5,7,39]:
— Цефалексин** (Код ATX: J01DB01) Взрослые и дети старше 10 лет — 500 мг 2 раза в сутки, дети до 10 лет — 25-50 мг/кг/сутки в 2 приема, но не более 1000 мг в сутки в течение 10 дней (детям с 3 мес.) [5,39].
— Цефуроксим** (АТХ код: J01DC02) 250 мг 2 раза в сутки внутрь у взрослых и, в большинстве случаев, у детей старше 2 лет — разовая доза составляет 125 мг 2 раза в сутки, максимальная суточная доза 250 мг (детям с 3-6 месяцев: 40-60 мг 2 раза в сутки, с 6 месяцев до 2 лет: 60 -120 мг 2 раза в сутки). Длительность терапии — 10 дней [5,7,25].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
— Цефиксим (АТХ код: J01DD08) [5,7,32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) – в детской практике.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 1) — во взрослой практике.
— Цефдиторен (АТХ код: J01DD16) — взрослые и дети старше 12 лет 200 мг 2 раза в сутки 10 дней [40]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
Комментарии: Вероятность развития перекрестных аллергических реакций на цефалоспорины 1-го поколения и цефалоспорины -2-го поколенияу пациентов с аллергией на бета-лактамные антибактериальные препараты: пенициллины невысока [5,39,41,42] и не превышает 10% [43,44,45,46].
Однако отсутствие унифицированных методов регистрации факта непереносимости бета-лактамных антибактериальных препаратов: пенициллинов в первичной документации пациента и отсутствие достоверных методов диагностики гиперчувствительности на бета-лактамные антибактериальные препараты: пенициллины в текущей российской клинической практике ограничивает возможности назначения цефалоспоринов 2-го поколения и цефалоспоринов 3-го поколения в случае наличия у пациента анамнестических указаний на гиперчувствительность немедленного типа на бета-лактамные антибактериальные препараты: пенициллины.
- Рекомендуется в случае наличия в анамнезе анафилактических реакций или доказанной аллергии на бета-лактамные антибактериальные препараты: пенициллины и другие бета-лактамные антибактериальные препараты использовать макролиды или линкозамиды [5,14,47,48,49,50].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
— Кларитромицин** (Код ATX: J01FA09) 7,5 мг/кг 2 раза в сутки (максимальная — 500 мг 2 раза в день).внутрь у взрослых и детей старше 12 лет, курс: 5-14 дней, детям 15 мг/кг/сут в 2 приема, максимально 1000 мг/сут;
— Клиндамицин** (Код ATX: J01FF01) взрослые и дети старше 12 лет: 600-1800 мг/сут внутрь в 2, 3 или 4 приема (равные дозы)
Возможно применение в указанных в инструкции по медицинскому применению лекарственных препаратов дозировках других бета-лактамных антибактериальных препаратовв и макролидов, имеющих в перечне показаний к применению диагноз «острый тонзиллит», «острый фарингит» или «ангина» (в том числе, джозамицин** (Код ATX: J01FA07), мидекамицин (Код ATX: J01FA03)).
- Рекомендуемая длительность терапии, необходимая для эрадикации БГСА, составляет 10 дней [2,4,5,51].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется применение бензатина бензилпенициллина** (Код ATX: J01CE08) только при наличии сомнений в комплаентности пациентов, в качестве альтернативы курсу пероральной антибактериальной терапии [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Не рекомендовано профилактическое назначение антибактериальных препаратов системного действия при вирусном ОТФ [5,14,7,52,53].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
- Рекомендуется проведение симптоматической системной терапии для купирования лихорадки и/или болевого синдрома. Возможно использование системных препаратов из групп: нестероидные противовоспалительные и противоревматические препараты (ибупрофен** (Код ATX: M01AE01), и или другие анальгетики и антипиретики (парацетамол** (Код ATX: N02BE01) и или ацетилсалициловая кислота** (Код ATX: N02BA01) [1,5,54,55,56,64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии:
Следует предостеречь от необоснованного приема препаратов, оказывающих жаропонижающие действие здоровым детям старше 3 мес следует назначать в случае, если температура тела у ребенка превышает 39,0 °С (измеренная ректально) или 38,5 °С (измеренная субаксиллярно) и/или при ломящих болях в мышцах и головной боли) [Оказание стационарной помощи детям. Руководство по лечению наиболее распространенных болезней у детей. Карманный справочник, второе издание, 2013г.-438с., доступно по ссылкеhttps://apps.who.int/iris/bitstream/handle/10665/81170/9789244548370_rus.pdf;jsessioni sequence=7, Федеральные клинические рекомендации по оказанию скорой медицинской помощи при острой лихорадке у детей. Минздрав РФ. Союз педиатров России. Российское общество скорой медицинской помощи. M.: 2015, 10]. Необоснованное медикаментозное купирование лихорадки может затруднить объективную оценку эффективности начатой АМТ при стрептококковом ОТФ.
Дозы ибупрофена** (Код ATX: M01AE01) — 200-400 мг у взрослых и 7,5 мг/кг у детей каждые 6-6-8 ч (максимально 30 мг/кг/сут))
Дозы парацетамола** (Код ATX: N02BE01) — 500-1000 мг у взрослых и 10-15 мг/кг у детей каждые 6 ч (максимально 60 мг/кг/сут))
Дозы ацетилсалициловой кислоты** (Код ATX: N02BA01)- у детей старше 15 лет и взрослых 0,5-1 г (не более 3 г в сутки)
У пациентов взрослого возраста возможно применение препаратов кетопрофена** (Код ATX: M01AE03). Определённые фармакологические преимущества имеют производные пропионовой кислоты с действующим веществом в виде кетопрофена лизиновой соли. Кетопрофена лизиновая соль, в отличие от неизмененного кетопрофена, оказывает быстрое противовоспалительное, обезболивающее и жаропонижающее действие., Кетопрофен** с действующим веществом в виде кетопрофена лизиновой соли имеет различные формы выпуска в частности, гранулы для приготовления раствора для приема внутрь, разрешённые к применению с целью купирования болевого синдрома у детей с 6 лет [55,56].
- Рекомендуется пациентам с ОТФ при выраженной боли в горле с учетом необходимости, переносимости и возраста пациента, применение топических препаратов, например:
— гексэтидин (противопоказан детям младше 3-х лет) (Код ATX: A01AB12)
— кетопрофен (противопоказан детям младше 12 лет) Код ATX: A01AD11,
— бензидамина (противопоказан детям младше 3-х лет) (Код ATX: A01AD02) и др. [55,56,60,63,64,65].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Местное лечение ОТФ имеет целью максимально быстро облегчить симптомы заболевания.
Топические лекарственные препараты выпускаются в виде спреев, растворов для полоскания или таблеток для рассасывания. У детей при отсутствии навыков полоскания горла и опасности аспирации при рассасывании таблеток, предпочтительна форма спрея. Ввиду риска реактивного ларингоспазма, топические препараты назначаются с возраста 2,5-3 лет. Американское общество семейных врачей не рекомендует применение препаратов безрецептурного отпуска детям до 4 лет [65]. Не следует при боли в горле рутинно использовать местные средства в виде «втирания», «смазывания» миндалин, а также механически удалять налеты.
При назначении местных препаратов обладающих антисептическим действием: грамицидин С+ (Код ATX: R02AB30), гексэтидин (Код ATX: A01AB12), лизоцим+пиридоксин (Код ATX: R02AA20), амилметакрезол+дихлорбензиловый спирт (Код ATX: R02AA20), хлоргексидин** (Код ATX: D08AC02), препараты йода (Код ATX: R02AA), бензилдиметил [3-(миристоиламино)пропил] аммоний хлорид моногидрат (Код ATX: D08AJ), биклотимол (Код ATX: R02AA20) и др., следует придерживаться разрешенной кратности приема и возрастных ограничений в связи с определенной токсичностью некоторых из них (хлоргексидин** (Код ATX: D08AC02)) и учитывать возможность развития аллергических реакций (препараты йода (Код ATX: R02AA)).
Прочие препараты для лечения полости рта: бензидамин (противопоказан детям до 3-х лет) (Код ATX: A01AD),, и прочие препараты для лечения заболеваний горла флурбипрофен (противопоказан детям до 12 лет) (Код ATX: R02AX01), могут входить как в состав комплексных средств, так и применяться в виде монопрепаратов.
Следует помнить, что местное лечение не может заменить назначения антибактериальных препаратов системного действия при ОТФ, вызванном БГСА [5].
- Рекомендовано применение препаратов природного происхождения – Тонзилгон (Код ATX: R02AA20), оказывающего комплексное действие на ключевые звенья патогенеза ОТФ, включая рецидивирующий ОТФ, курсами в межрецидивный период с целью профилактики рецидивов, улучшения течения ОТФ [57,58,76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2).
Комментарии: для получения прогнозируемого клинического эффекта и минимизации нежелательных явлений используются препараты, стандартизованные по составу и содержанию биологически активных веществ, имеющие доказательные исследования. Лекарственное средство, имеющее в своем составе корень алтея, цветки ромашки аптечной, траву тысячелистника, кору дуба, листья грецкого ореха, траву хвоща и траву одуванчика (Код ATX: R02AA20) продемонстрировало высокую фармакологическую эффективность у пациентов, как с острой, так и с рецидивирующей патологией небных миндалин, т. к. обладает доказанным иммуномодулирующим, антисептическим, антибактериальным, противовирусным и противовоспалительным действием. Этот фитопрепарат может быть назначен на продолжительный срок, беременным и пациентам с соматическими заболеваниями [57,58].
- Рекомендовано пациентам с рецидивирующими формами ОТФ с целью профилактики рецидивов применение препарата, содержащего пидотимод (противопоказан детям до 3-х лет) (Код АТХ: L03AX05) [59,60]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: применение пидотимода (Код АТХ: L03AX05) сопровождается повышением функциональной активности макрофагов, дендритных клеток, нейтрофилов, циркулирующих моноцитов, натуральных киллеров, а также Т- и В-лимфоцитов и способствует, таким образом снижению рецидивов ОТФ [59.61].
- Рекомендовано пациентам с рецидивирующими формами ОТФ с целью профилактики рецидивов, а также восстановления нормобиоты слизистой оболочки ротоглотки после перенесенного заболевания, применение биологически активных добавок, содержащих в своем составе микроорганизмы, относящиеся к индигенным бактериям слизистой оболочки ротоглотки [73,75,77].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: К таким средствам относится содержащий в своем составе S. salivarius, штамм К12, продуцирующий ингибирующие вещества (BLIS) – антимикробные пептиды. [73, 74, 75].
1.1. Диетотерапия
Пациентам, страдающим ОТФ показано ограничение раздражающей пищи. Пища должна иметь мягкую консистенцию.
- Рекомендовано всем пациентам, страдающим ОТФ ограничение раздражающей пищи (острое, кислое, соленое, горячее, холодное и т.д. при этом пища должна иметь мягкую консистенцию [78,79].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Не рекомендуется хирургическое лечение при неосложненном течении ОТФ [5,29,66,65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Не требуется.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Прогноз ОТФ в большинстве случаев благоприятный.
Риск развития гнойных осложнений повышается на фоне первичных и приобретенных иммунодефицитных состояний (врожденный иммунодефицит, прием иммуносупрессивной и цитостатической терапии, ВИЧ-инфекция). Риск развития аутоиммунных осложнений повышается у пациентов с острой ревматической лихорадкой в анамнезе и у ближайших родственников.
Осложнения
Отсутствие лечения или неадекватное лечение стрептококкового тонзиллита чревато высокой вероятностью развития серьезных гнойных осложнений:
- паратонзиллярный, парафарингеальный, ретрофарингеальный абсцессы,
- гнойный лимфаденит;
а также негнойных:
- острая ревматическая лихорадка,
- ревматические болезни сердца,
- постстрептококковый гломерулонефрит,
- синдром стрептококкового токсического шока (Strep TSS),
- PANDAS-синдром.
Любой случай ОТФ с вероятной этиологией БГСА требует этиологической диагностики.
Госпитализация
Организация оказания медицинской помощи
Организация оказания медицинской помощи, показания к госпитализации и выписке
Организация медицинской помощи осуществляется согласно Алгоритму ведения пациента (приложение Б).
Лечение в большинстве случаев осуществляется амбулаторно, врачом-педиатром или врачом общей практики (семейным врачом) или врачом-терапевтом.
Улучшение состояния после начала АМТ при тонзиллите, вызванном БГСА, наблюдается уже через 12-24 ч. Пациент не обязан находиться дома в течение всего времени приема антибиотика (10 дней). Согласно МУ 3.1.1885-04 «Эпиднадзор и профилактика стрептококковой группы А инфекции»: «Допуск в детские учреждения – после полного клинического выздоровления» [69].
Госпитализации в инфекционное отделение, при его отсутствии – в боксированное педиатрическое отделение требуют пациенты в тяжелом состоянии, при необходимости инфузионной терапии ввиду отказа ребенка от еды и жидкости.
Неэффективность лечения, подозрение на гнойное осложнение (паратонзиллярный, парафарингеальный, ретрофарингеальный абсцесс, гнойный лимфаденит), атипичная фарингоскопическая картина (подозрение на новообразование), необходимость хирургического вмешательства (дренирование абсцесса, биопсия, тонзиллэктомия) являются показанием для консультации врача-оторинолариноголога и госпитализации в соответствующее хирургическое отделение.
Выписка из стационара осуществляется при устойчивом купировании проявлений болезни и отсутствии угрозы жизни и здоровью пациента.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфической профилактики БГСА ОТФ не существует.
- Рекомендуется ограничение контактов больных ОТФ для профилактики воздушно-капельного пути распространения инфекции [5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется изоляция от организованных коллективов больных острым стрептококковым тонзиллофарингитом во избежание вспышек стрептококковой инфекции (скарлатины — при заболевании, обусловленном токсигенными штаммами БГСА) [5].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
2. Диспансерное наблюдение
Осуществляется при необходимости в соответствии с СП 3.1.2. 3149-13 [68]:
- после выписки из стационара с БГСА ОТФ установить диспансерное наблюдение в течение одного месяца с контролем общего (клинического) анализа крови развернутого и общего (клинического) анализа мочи через 7-10 дней и через 3 недели, при наличии жалоб или клинических проявлений осложнений (или подозрения на них) со стороны сердечно-сосудистой системы – дополнительно – электрокардиография
- при отсутствии отклонений пациенты снимаются с диспансерного учета через один месяц.
- Детям после выписки из стационара с БГСА ОТФ при выявлении отклонений при физикальном осмотре, в результатах лабораторных и/или инструментальных исследований консультация и/или наблюдение соответствующего специалиста (при изменениях в общем (клиническом) анализе мочи – врача-нефролога, клинических и/или лабораторных признаках ревматической лихорадки – врача-ревматолога, признаках вовлечения сердечно-сосудистой системы – врача- детского кардиолога)
Информация
Источники и литература
-
Клинические рекомендации Национальной медицинской ассоциации оториноларингологов
- 1. Карнеева О.В., Дайхес Н.А., Поляков Д.П. Протоколы диагностики и лечения острых
тонзиллофарингитов. Русский медицинский журнал «Оториноларингология». 2015;
№ 6: с. 307-311.
2. Kenealy T. Sore throat. BMJ Clin Evid. 2014;2014:1509. Published 2014 Mar 4;2014:1509
3. Поляков Д.П. Современные аспекты диагностики острого стрептококкового
тонзиллофарингита у детей// Вопросы современной педиатрии — 2013; 12 (3): 46–51.
4. ESCMID Sore Throat Guideline Group, Pelucchi C, Grigoryan L, Galeone C, Esposito S,
Huovinen P, Little P, Verheij T. Guideline for the management of acute sore throat. Clin
Microbiol Infect. 2012 Apr;18 Suppl 1:1-28. doi:10.1111/j.1469-0691.2012.03766.x
5. Shulman S.T., Bisno A.L., Clegg H.W., Gerber M.A., Kaplan E.L., Grace L., Martin J.M.,
Beneden C.V. Clinica practice guideline for the diagnosis and management of group A
Streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America.
2012: 1-17.
6. McIsaac W.J., Goel V., To T., Low D.E. The validity of sore throat score in family practice.
CMAJ. 2000; 163(7): 811-815.
7. Яковлев С.В. Стратегия и тактика рационального применения антимикробных
средств в амбулаторной практике. Вестн. Практ. Врача. 2016; №1: 23-28.
8. Oliver J, Malliya Wadu E, Pierse N, Moreland NJ, Williamson DA, Baker MG. Group A
Streptococcus pharyngitis and pharyngeal carriage: A meta-analysis. PLoS Negl Trop Dis.
2018;12(3):e0006335. Published 2018 Mar 19. doi:10.1371/journal.pntd.0006335
9. Low DE. Non Pneumococcal streptococcal infections, rheumatic fever. In: Goldman L,
Schafer AI, editors. Goldman»s Cecil Medicine. 24th edition. Philadelphia: Elsevier
Saunders. Volume 2, 2012. p. 1823-1829
0. Choby BA. Diagnosis and treatment of streptococcal pharyngitis [published correction
appears in Am Fam Physician. 2013 Aug 15;88(4):222. Dosage error in article text]. Am
Fam Physician. 2009;79(5):383-390
1. Fine AM, Nizet V, Mandl KD. Large-scale validation of the Centor and McIsaac scores to
predict group A streptococcal pharyngitis. Arch Intern Med. 2012;172(11):847-852.
doi:10.1001/archinternmed.2012.950.
2. Fornes Vivas R, Robledo Díaz L, Carvajal Roca E, Navarro Juanes A, Pérez Feito C. Utilidad
de los criterios clínicos para el adecuado diagnóstico de la faringoamigdalitis en la
urgencia pediátrica [Utility of clinical criteria for the adequate diagnosis of the
pharingoamigdalitis in the pediatric emergency service]. Rev Esp Salud Publica.
2019;93:e201911061. Published 2019 Nov 20
3. Thai TN, Dale AP, Ebell MH. Signs and symptoms of Group A versus Non-Group A strep
throat: A meta-analysis. Fam Pract. 2018;35(3):231-238. doi:10.1093/fampra/cmx072
4. Дарманян А.С. Совершенствование методов диагностики и лечения острых
тонзиллитов у детей. Диссертация канд. мед. наук. М, 2010.
5. Boccazzi A., Garotta M., Pontari S., Agostoni C.V. Streptococcal tonsillopharyngitis:
clinical vs. microbiological diagnosis. Infez Med. 2011; 19(2):100-105.
6. Cohen JF, Bertille N, Cohen R, Chalumeau M. Rapid antigen detection test for group A
streptococcus in children with pharyngitis. Cochrane Database Syst Rev.
2016;7(7):CD010502. Published 2016 Jul 4. doi:10.1002/14651858.CD010502.pub2,
7. Stewart EH, Davis B, Clemans-Taylor BL, Littenberg B, Estrada CA, Centor RM. Rapid
antigen group A streptococcus test to diagnose pharyngitis: a systematic review and metaanalysis.
PLoS One. 2014 Nov 4;9(11):e111727
8. Giraldez-Garcia C, Rubio B, Gallegos-Braun JF, Imaz I, Gonzalez-Enriquez J, Sarria-
Santamera A. Diagnosis and management of acute pharyngitis in a paediatric population:
a cost-effectiveness analysis. Eur J Pediatr. 2011 Aug;170(8):1059-67. Doi:10.1007/s00431-
011-1410-0
9. Snow V, Mottur-Pilson C, Cooper RJ, Hoffman JR. Principles of appropriate antibiotic use
for acute pharyngitis in adults. Ann Intern Med 2001; 134:506–8.
20. Роспотребнадзор. Инфекционная заболеваемость в Российской федерации 2015,
2016, 2017, 2018, 2019,2020.
21. Отвагин, И. В. Современные аспекты диагностики инфекций, вызванных
стрептококками группы А / И. В. Отвагин, Н. С. Соколов // Клиническая
микробиология и антимикробная химиотерапия. – 2011. – Т. 13. – № 3. – С. 223-230.
URL: https://cyberleninka.ru/article/n/sovremennye-aspekty-diagnostiki-infektsiyvyzvannyh-
streptokokkami-gruppy-a (дата обращения: 12.08.2021).
22. Свистушкин, В. М. Национальные рекомендации по лечению больных острыми
респираторными инфекциями верхних отделов дыхательных путей: что важно знать
терапевту? / В. М. Свистушкин, Л. А. Топоркова // Фарматека. – 2017. – № S2. – С. 15-
21.
23. Robert W. Wolford; Amandeep Goyal; Shehla Yasin Belgam Syed; Timothy J. Schaefer.
Pharyngitis StatPearls Publishing; Last Update: May 22, 2020
https://www.ncbi.nlm.nih.gov/books/NBK519550
24. Windfuhr JP, Toepfner N, Steffen G, Waldfahrer F, Berner R. Clinical practice guideline:
tonsillitis I. Diagnostics and nonsurgical management. Eur Arch Otorhinolaryngol. 2016
Apr;273(4):973-87
25. Таточенко В.К. Антибиотико- и химиотерапия инфекций у детей. М.: ИПК
Континент-Пресс, 2008 – 256с.
26. Kalra MG, Higgins KE, Perez ED. Common Questions About Streptococcal Pharyngitis
[published correction appears in Am Fam Physician. 2017 Apr 1;95(7):414]. Am Fam
Physician. 2016;94(1):24-31.
27. Førsvoll J., Kristoffersen EK, Øymar K. The immunology of the periodic fever, aphthous
stomatitis, pharyngitis and cervical adenitis syndrome; what can the tonsils reveal. A
literature review. Int. J. Pediatr. Otorhinolaryngol. 2019. Nov.25; 130:109795.
doi:10.1016/j.ijporl.2019.1097957
28. Артюшкин, С. А. Дифференциальная диагностика и рациональная терапия вирусных
поражений верхних дыхательных путей / С. А. Артюшкин, Н. В. Еремина // РМЖ. –
2016. – Т. 24. – № 4. – С. 245-250.
29. Chiappini E., Regoli M., Bonsignori F., Sollai S., Parretti A., Galli L., de Martino M. Analysis
of different recommendations from international guidelines for the management of acute pharyngitis in adults and children. Clin Ther. 2011; 33(1): 48-58.
- 1. Карнеева О.В., Дайхес Н.А., Поляков Д.П. Протоколы диагностики и лечения острых
Информация
Список сокращений
АСЛ-О – антистрептолизин-О
АМТ – антимикробная терапия
БГСА – бета-гемолитический стрептококк группы А
ВЭБ – вирус Эпштейна-Барр
МКБ 10 – международная классификация болезней 10 пересмотра
НПВП – нестероидные противовоспалительные препараты (лекарственные средства групп Нестероидные противовоспалительные и противоревматические препараты (ибупрофен**, кетопрофен**)
ОТФ – острый тонзиллофарингит
ПЦР — полимеразная цепная реакция
PANDAS (Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal infections) — акроним «детские аутоиммунные нервно-психические расстройства, ассоциированные со стрептококковыми инфекциями»
Strep TSS (Toxic shock syndrome) — синдром стрептококкового токсического шока
Термины и определения
Острый тонзиллофарингит (ОТФ) – острое инфекционное воспаление слизистой оболочки и лимфатических структур ротоглотки (небные миндалины, лимфоидные фолликулы задней стенки глотки).
Экспресс-тест на бета-гемолитический стрептококк группы А – иммунохроматографический метод экспресс-диагностики для качественной оценки наличия антигена БГСА в материале со слизистой оболочки ротоглотки, выполняемый «у постели больного» в течение 5-15 минут.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Дайхес Н.А., д.м.н., профессор, член-корреспондент РАН, член Национальной медицинской ассоциации оториноларингологов
2. Баранов А.А. академик РАН, профессор, д.м.н., почетный Президент Союза педиатров России
3. Лобзин Ю.В., академик РАН, профессор, д.м.н., Президент Международной общественной организации «Евро-Азиатское общество инфекционных болезней» (МОО «ЕАОИБ
4. Намазова-Баранова Л.С., академик РАН, профессор, д.м.н., Президент Союза педиатров России
5. Козлов Р.С., член-корреспондент РАН, профессор, д.м.н, Президент МАКМАХ
6. Поляков Д.П., к.м.н., член Национальной медицинской ассоциации оториноларингологов
7. Карнеева О.В., д.м.н., член Национальной медицинской ассоциации оториноларингологов, член «Межрегиональной ассоциации ЛОР-педиатров»
8. Гуров А.В., д.м.н., профессор, член Национальной медицинской ассоциации оториноларингологов, член Альянса клинических химиотерапевтов и микробиологов
9. Яковлев С.В., д.м.н., профессор, президент Альянса клинических химиотерапевтов и микробиологов
10. Тулупов Д.А., к.м.н., член Национальной медицинской ассоциации оториноларингологов
11. Рязанцев С.В., д.м.н., профессор, член Национальной медицинской ассоциации оториноларингологов
12. Гаращенко Т.И., д.м.н., профессор, член Национальной медицинской ассоциации оториноларингологов, член «Межрегиональной ассоциации ЛОР-педиатров»
13. Ким И.А., д.м.н., член Национальной медицинской ассоциации оториноларингологов
14. Полякова А.С., к.м.н., не является членом профессиональной ассоциации
15. Трухин Д.В., член Национальной медицинской ассоциации оториноларингологов
16. Андреева И.В., ст.н.с., доцент, член МАКМАХ
17. Бабаченко И.В., д.м.н., профессор, член Международной общественной организации «Евро-Азиатское общество инфекционных болезней» (МОО «ЕАОИБ»)
18. Бакрадзе М.Д., д.м.н., профессор, член Союза Педиатров России
19. Вишнева Е.А., д.м.н., член Союза педиатров России
20. Куличенко Т.В. д.м.н., профессор,член Союза педиатров России
21. Селимзянова Л.Р., к.м.н., член Союза педиатров России
22. Стецюк О.У., ст.н.с., член МАКМАХ
23. Таточенко В.К., д.м.н., профессор, член Союза Педиатров России
24. Усков А.Н., доцент, д.м.н., член Международной общественной организации «Евро-Азиатское общество инфекционных болезней»
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-педиатры
- Врачи общей врачебной практики (семейные врачи)
- Врачи-инфекционисты
- Врачи-оториноларингологи
- Студенты медицинских ВУЗов
- Обучающиеся в ординатуре
Методология разработки клинических рекомендаций основана на всестороннем анализе актуального состояния проблемы, изучения данных литературы, нормативных правовых актов с последующим обсуждением в профессиональной среде и внесении изменений по результатам резолюций конференций и национальных конгрессов в случае их утверждения в Министерстве здравоохранения.
В клинических рекомендациях обобщен опыт авторов по диагностике и лечению больных с острым синуситом. Клинические рекомендации содержат в себе сведения, необходимые для диагностики, дифференциальной диагностики, выбора метода лечения больных с острым синуситом.
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокхрейновскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 10 лет.
Методы, использованные для оценки качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости в соответствии с рейтинговой схемой.
Целевая аудитория клинических рекомендаций:
врачи общей практики (семейные врачи);
врачи-оториноларингологи;
врачи-сурдологи-оториноларингологи;
врачи-педиатры;
врачи-педиатры городские (районные); врачи-педиатры участковые;
врачи скорой медицинской помощи;
старшие врачи станций (отделений) скорой медицинской помощи;
врачи-терапевты;
врачи-терапевты подростковые;
врачи-терапевты участковые;
врачи-терапевты участковые цеховых врачебных участков; врачи-инфекционисты;
судовые врачи.
Таблица 1.Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
На процессе оценки, несомненно, может сказываться и субъективный фактор. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо, т.е. по меньшей мере двумя независимыми членами рабочей группы. Какие-либо различия в оценках обсуждались уже всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств:
Таблицы доказательств заполнялись членами рабочей группы.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему
медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Проект рекомендаций был рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Нормативно-правовые документы
1. Порядок оказания медицинской помощи по профилю «оториноларингология»:
Приказ Министерства здравоохранения РФ от 12 ноября 2012 г. № 905н «Об утверждении Порядка оказания медицинской помощи населению по профилю «оториноларингология». Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»;
2. Приказ Министерства здравоохранения и социального развития РФ от от 05.05.2012 N 521н «Об утверждении Порядка оказания медицинской помощи детям с инфекционными заболеваниями»
3. Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru
4. Приказ МЗ РФ от 20 декабря 2012г. № 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
5. Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
6. Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций».
7. Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
8. Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг».
9. Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения»
10. «Эпидемиологический надзор и профилактика стрептококковой (группы А) инфекции». Методические указания. МУ 3.1.1885-04» (Утв. Главным государственным санитарным врачом РФ 04.03.2004).
11. «Эпидемиологический надзор за дифтерийной инфекцией» Методические указания. МУ 3.1.1082-01 (Утв. Главным государственным санитарным врачом РФ 09.11.2001).
12. Профилактика стрептококковой (группы А) инфекции Санитарно-эпидемиологические правила СП 3.1.2.3149-13 Утверждены Постановлением врио Главного государственного санитарного врача Российской Федерации от 18 декабря 2013 г. № 66 ttps://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=1773
Расшифровка примечаний
** – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год (Распоряжение Правительства РФ от 12.10.2019 № 2406-р)
# — применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет. Требует выполнения следующей процедуры:
1. Обоснование необходимости назначения лекарственного средства «вне инструкции» в медицинской карте.
2. Проведение врачебной комиссии медицинской организации.
3. Подписание пациентом/законным представителем пациента (для несовершеннолетних) добровольного информированного согласия. Форма согласия должна быть утверждена в медицинской организации.
Согласно:
— п.5. ФЗ № 323-ФЗ от 21 ноября 2011 г. «Об основах охраны здоровья граждан в Российской Федерации»
— Приказ Министерства здравоохранения и социального развития РФ от 9 августа 2005 г. № 494 «О порядке применения лекарственных средств у больных по жизненным показаниям»
— Приказ от 5 мая 2012 г. № 502н «Об утверждении Порядка создания и деятельности врачебной комиссии медицинской организации”
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Острый тонзиллит (воспаление горла, иногда также называемое «ангина») – воспаление миндалин, как правило, сопровождающееся болью в горле и подъемом температуры тела, а также, возможно, появлением налетов на миндалинах. Острый фарингит – воспаление задней стенки глотки. Как правило, эти два процесса протекают параллельно, в связи с чем врачи используют термин острый тонзиллофарингит. Острый тонзиллофарингит может быть вызван вирусами или бактериями. Единственный бактериальный тонзиллофарингит, при котором необходимо назначение антибактериальных препаратов, это тонзиллит, вызванный бета-гемолитическим стрептококком группы А (или Streptococcus pyogenes). Другие микробы могут присутствовать в полости рта в норме (например, Staphylococcus aureus).
Острый тонзиллофарингит, вызванный вирусами, проходит самостоятельно в течение 1-2 недель. Антибиотики не ускоряют выздоровление при данном заболевании. Более того, приём антибиотиков без необходимости может причинить вред, способствуя появлению бактерий, устойчивых к их действию, и повысить риск развития нежелательных реакций.
Стрептококковый тонзиллофарингит проявляется болями в горле, значительным повышением температуры тела (38°С и выше), отёком миндалин, появлением, в большинстве случаев, белых пятен или гнойных налётов на слизистой оболочке миндалин, нёба и задней стенки глотки, увеличением и болезненностью лимфатических узлов, расположенных на шее. Заболевание заразно, наиболее часто встречается у детей в возрасте от 5 до 15 лет.
По внешним признакам точно определить, вызвано ли заболевание вирусом или бактериями, затруднительно, так как картина заболевания может быть сходной. На основании клинических проявлений врач может заподозрить стрептококковую природу заболевания, но для подтверждения диагноза необходимо провести специальное бактериологическое обследование. Существуют классические методы обследования и экспресс-диагностика, позволяющие быстро установить диагноз и назначить лечение.
Если Вам или вашему ребенку назначены антибиотики, очень важно принимать препарат так, как назначил врач, обязательно соблюдая длительность курса лечения, несмотря на то, что Вам или Вашему ребенку станет лучше значительно раньше или все признаки заболевания прошли. Обычная длительность курса антибиотиков по поводу острого стрептококкового тонзиллита составляет 10 дней. Только такая продолжительность лечения обеспечивает эрадикацию стрептококка (т.е. помогает полностью избавиться него).
В большинстве случаев острый тонзиллофарингит сопровождается болью при глотании, поэтому рекомендуется давать пациенту негорячую мягкую пищу, которую ему будет легче проглотить.
При повышении температуры, сильной боли в горле возможно применение парацетамола** или ибупрофена**. Также эффективно полоскание горла препаратами с обезболивающим эффектом. Возможно использование препаратов обладающих противовоспалительным и обезболивающим действием в виде спреев или таблеток (пастилок, леденцов) для рассасывания (в зависимости от возраста и предпочтений пациента). Для выбора наиболее подходящего препарата для Вас или Вашего ребенка и необходимости такого лечения посоветуйтесь с врачом.
Вирусы и бактерии распространяются при прикосновении рук ко рту, носу или глазам. Частое мытьё рук тёплой водой с мылом поможет предотвратить инфицирование.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Модифицированная шкала оценки Центора (Centor score) и МакАйзека (McIsaac
score) [71,72]
Источник: Fine AM, Nizet V, Mandl KD. Large-scale validation of the Centor and McIsaac scores to predict group A streptococcal pharyngitis. Arch Intern Med. 2012;172(11):847-852. doi:10.1001/archinternmed.2012.950.
Тип: шкала оценки
Назначение: дифференциальная диагностика вирусного и стрептококкового ОТФ по клинической картине
Таблица 1 Балльная оценка симптомов пациента с болью в горле
Ключ (интерпретация):
Таблица 2 Шкала МакАйзека (McIsaac score): Тактика ведения пациента в зависимости от бальной оценки при ОТФ
Пояснения
Сначала рекомендуется оценить симптомы у пациента с болью в горле по балльной шкале (таблица 1), оценить вероятность наличия БГСА, а затем ответить на вопрос, назначать АБТ или нет (таблица 2) [72].
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Введение
Боль в горле, развивающаяся в результате инфекционного воспаления верхних дыхательных путей, служит одним из наиболее частых поводов обращения пациентов всех возрастов к специалистам амбулаторного звена, включая оториноларингологические, терапевтические, педиатрические службы, а также семейных врачей и врачей общей практики. Наиболее часто данный симптом возникает при острых респираторных инфекциях (ОРВИ, ОРЗ, назофарингит, ларингофарингит), а также на фоне изолированного поражения глотки (фарингит, тонзиллит, тонзиллофарингит) [1–3].
Актуальность проблемы терапии состояний, сопровождающихся болью в горле, помимо значительной распространенности самих заболеваний, определяется еще рядом аспектов (см. рисунок). Так, несмотря на особенности этиологии, которые кратко будут обсуждаться ниже, боль в горле на протяжении многих десятков лет является одним из самых частых поводов для назначения системных антибактериальных препаратов в качестве базисной терапии [4–6]. В свою очередь, высокая частота применения системных антибактериальных препаратов для лечения боли в горле во многом способствует дальнейшему росту антибиотикорезистентности [6, 7]. Наконец, значительное внимание в последние годы уделяется влиянию антибактериальной терапии на качественно-количественный состав микробиоты [8].
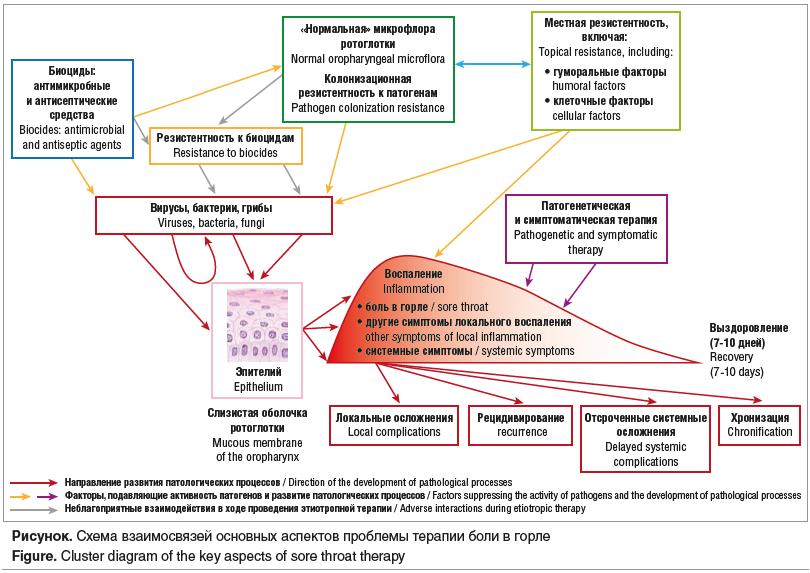
Этиология инфекционных заболеваний, сопровождающихся болью в горле
Среди этиологических факторов инфекционных заболеваний, сопровождающихся болью в горле, вне зависимости от возраста пациентов, доминируют респираторные вирусы (аденовирус, вирус Эпшейна — Барр, вирусы гриппа B и парагриппа, респираторно-синтициальный вирус, риновирус, бокавирус, метапневмовирус). У детей младше 3 лет частота воспалительных заболеваний глотки вирусной этиологии может достигать 80–90%, но по мере взросления возрастает доля «бактериального» генеза данного заболевания (24% в дошкольном возрасте против 52% в старшем школьном возрасте) [7, 9, 10]. По данным результатов исследований, проведенных в период пандемии COVID-19, вирус SARS-CoV-2 (штаммы дельта и омикрон) также может быть причиной возникновения боли в горле на фоне легкого течения инфекции [11].
Несмотря на то, что, по данным литературы, среди бактериальных возбудителей (особенно у детей от 3 лет и подростков до 15 лет) лидирующая роль по частоте и клинической значимости отводится Streptococcus pyogenes (β-гемолитический стрептококк группы А (БГСА)) [2, 7, 9], существуют работы, в которых исследователи демонстрируют меньшую значимость этого возбудителя в генезе острого тонзиллофарингита у педиатрических пациентов [10, 12].
По результатам исследований, нацеленных на выявление этиологической значимости других возбудителей, обсуждается возможная этиологическая роль гемолитических стрептококков групп С и G, Fusobacterium necrophorum, Arcanоbacterium haemolyticum, Mycoplasma pneumoniae, Chlamydophila pneumoniae [9, 13, 14].
Современные подходы к диагностике и лечению заболеваний, сопровождающихся болью в горле
В соответствии с современными отечественными и международными клиническими рекомендациями инфекции, вызываемые БГСА, требуют лечения с применением системных антибактериальных препаратов с целью предупреждения развития метатонзиллярных и системных осложнений. В настоящее время «золотым стандартом» для подтверждения стрептококковой этиологии заболевания являются экспресс-тесты, основанные на выявлении антигенов или ДНК возбудителя, хотя использование клинических шкал (Centor score, McIsaac score, FeverPain) также допускается. Следует подчеркнуть, что проведение экспресс-тестов не рекомендуется в возрастных категориях, для которых БГСА-этиология не является преобладающей (дети младше 3 лет, пациенты старше 50 лет). У детей старше 3–5 лет и подростков в сомнительных случаях (при расхождении результатов экспресс-диагностики с клиническими шкалами), а также в группах риска по развитию осложнений рекомендуется проведение классического бактериологического метода исследования [7, 9, 15].
С учетом сохраняющейся высокой чувствительности БГСА к β-лактамным антибиотикам, препаратами первой линии терапии являются пенициллины (предпочтительно применение амоксициллина). В случаях аллергии на препараты пенициллинов назначаются цефалоспорины, а при непереносимости всей β-лактамной группы — макролиды. Однако следует учитывать, что за последнее десятилетие отмечается существенный рост устойчивости БГСА к препаратам этой группы, а также к линкозамидам. Во всех остальных случаях абсолютное большинство клинических руководств рекомендуют проводить лишь симптоматическую терапию, направленную на купирование боли и других сопутствующих жалоб [2, 7, 9, 15]. Обсуждается применение топических препаратов, обладающих противовоспалительными свойствами, а также анестетиков и антисептиков [16, 17].
Среди причин для отказа от применения именно системных антибиотиков отмечаются риски формирования устойчивости, развития системных нежелательных явлений и отрицательного влияния на микробиоту макроорганизма. Для сокращения использования системных антибактериальных препаратов рекомендуется строгое следование клиническим руководствам (тщательная, последовательная клиническая и лабораторная диагностика) — так называемый «умный» выбор терапии, тактика отсроченного назначения препаратов. Кроме того, в ряде обзоров отмечается, что даже нелеченые случаи БГСА-фарингитов склонны к самоизлечению, и с учетом низкой частоты развития отсроченных осложнений обсуждается возможность отказа от применения системных антибактериальных препаратов у иммунокомпетентных пациентов [15].
Несмотря на активно предпринимаемые усилия, включая создание клинических руководств, различные образовательные проекты и контроль за назначениями, медицинское сообщество испытывает значительные затруднения в реализации стратегий снижения частоты использования системных противомикробных препаратов среди практикующих специалистов различных стран, в том числе стран Европы и Америки с высокоразвитыми системами здравоохранения [2, 4, 6, 18].
Согласно результатам проведенных исследований инфекционно-воспалительные заболевания, сопровождающиеся болью в горле, в значительной степени снижают качество жизни пациентов. Большинство обратившихся за медицинской помощью связывают более выраженную боль именно с развившейся инфекцией, что во многом определяет выбор врача в пользу этиотропной терапии [19].
При более тщательном изучении этиологического профиля с одновременной детекцией вирусных и бактериальных возбудителей очень часто выявляются вирусно-бактериальные ассоциации [3, 10, 11, 20]. Однако авторам не удалось найти публикации результатов исследований, в которых наряду с выявлением вирусных и/или бактериальных возбудителей одновременно проводилось бы комплексное исследование их этиологической значимости по классическим серологическим методикам. В то же время в клинической практике при обсуждении этиотропной терапии не учитывается классический тезис: вирусы открывают ворота очага воспаления для экспансии бактерий, а также тот факт, что в реальности на слизистой оболочке ротоглотки одновременно присутствуют и вирусные, и бактериальные патогены. Именно в отношении патогенеза острого фарингита/тонзиллофарингита логично допустить постепенный, не сразу обозначаемый клиническими маркерами переход преобладающей этиологической роли от вирусов к бактериям, что, возможно, и отражается данными исследований, одновременно выявляющих вирусное и бактериальное присутствие [10, 20, 21].
Наконец, авторы обращают внимание на сочетание двух важных тенденций. С одной стороны, желание уйти от повсеместного применения системных антибактериальных препаратов широкого спектра действия с целью снизить давление на микроорганизмы в целом и в первую очередь снизить агрессивное воздействие на региональные биотопы и микробиом пациента. Следует отметить при этом, что даже в странах с самым высоким уровнем здравоохранения применение узконаправленных антибиотиков потребует проведения значительного комплекса диагностических мероприятий в режиме, приближающемся к режиму реального времени, что в настоящее время является трудноосуществимой стратегией [8]. Вторая важная тенденция заключается в активном применении препаратов, обладающих способностью преодолевать основные механизмы формирования микробной устойчивости, что также может обеспечить снижение угрозы распространения антибиотикорезистентности [22].
Не вдаваясь в подробное описание самих механизмов реализации устойчивости бактерий к действию противомикробных средств, отметим, что в основе их развития можно выделить два принципиально важных направления: мутации в собственном геноме и приобретение генов резистентности посредством горизонтального переноса, в том числе через плазмиды. Двумя другими важнейшими аспектами устойчивости микроорганизмов к действию противомикробных препаратов являются уменьшение их метаболической активности, в частности переход в состояние персистеров, и формирование биопленок. Оценивая перспективы преодоления резистентности и толерантности, следует признать, что с эволюционной точки зрения создание средств, воздействующих на возбудителя инфекции при полном отсутствии риска формирования резистентности, крайне маловероятно. Более реалистичный подход — разработка препаратов, действующих одновременно на несколько мишеней в бактериальной клетке [23].
К таким препаратам относятся антимикробные пептиды, в частности наиболее подробно изученные и длительно применяемые антимикробные полипептиды (АМП) микробного происхождения [24]. Топическое применение АМП благодаря прямому попаданию в очаг воспаления в адекватной и безопасной концентрации позволяет в большей мере, чем системное введение антибактериальных препаратов, добиваться быстрой и полной эрадикации возбудителя, купирования воспаления и болевого синдрома. В отличие от классических антибактериальных препаратов АМП действуют одновременно на несколько мишеней, основной из которых является цитоплазматическая мембрана бактериальной клетки. Гибель микроорганизмов (достижение быстрого бактерицидного эффекта) происходит в очень короткие сроки, что обусловливает существенно более низкий риск формирования устойчивости патогенов.
В фокусе — АМП
Грамицидин С
Учитывая вышесказанное, АМП микробного происхождения в последнее время рассматриваются в качестве перспективных средств лечения инфекционных заболеваний в условиях высокого риска развития антибиотикорезистентности к системным препаратам [25]. Так, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) включило вещества из группы грамицидинов в список одобренных к применению против инфекций, вызванных грамположительными и грамотрицательными бактериями [24].
В отличие от линейных грамицидинов, открытых Рене Дюбо в составе противомикробных полипептидов (тиротрицин), продуцируемых бактерией Aneurinibacillus migulanus (прежнее название — Bacillus brevis) в 1939 г. [26], циклический декапептид грамицидин С (грамицидин советский, ГС) был выделен Г.Ф. Гаузе и М.Г. Бражниковой и описан в 40-х годах ХХ в. [27].
Молекула ГС является жестким кольцом, обладает амфифильными свойствами за счет наличия заряженной положительно (катионной) и гидрофобной частей. В состав молекулы ГС, синтезируемой нерибосомальным путем, входит в числе других аминокислот крайне редко встречающийся в составе природных белков и пептидов L-орнитин. Высокая стабильность молекулы в совокупности с наличием в составе неканонической аминокислоты позволяет ГС сохранять бактерицидное действие в широком диапазоне pH и избегать протеолитической деградации обычными протеазами микроорганизмов [28].
Благодаря своим свойствам ГС характеризуется выраженным многоцелевым бактерицидным действием в отношении широкого спектра грамположительных и грамотрицательных бактерий и некоторых дрожжевых грибов. ГС активен в отношении как планктонных форм микроорганизмов, включая клетки-персистеры, так и в отношении биопленок [28–30]. Согласно данным исследований, проведенных в рамках поиска перспективных препаратов против SARS-CoV-2, была выявлена способность ГС значительно снижать вирусную нагрузку в клетках Vero, инфицированных SARS-CoV-2, в эффективной концентрации 1,57 мкг/мл с сохранением максимальной эффективности до 24 ч. Кроме того, протеомный анализ показал, что в инфицированных клетках на фоне применения ГС нарушались регуляция и синтез белков, связанных с размножением вируса в клетках in vitro [31].
Основным способом реализации бактерицидного действия ГС является нарушение строения и функции липидного бислоя плазматической мембраны бактерий вплоть до образования значительных дефектов в высокой концентрации. За счет низкой молекулярной массы и особенностей строения молекулы ГС обладает, в отличие от других антимикробных пептидов, более высокой проницаемостью и быстро попадает внутрь клеток грамположительных и грамотрицательных микроорганизмов. Кроме того, ГС нарушает процессы клеточного дыхания и деления клеток широкого спектра патогенных бактерий [28, 32, 33].
Дополнительно показано, что одной из ключевых мишеней ГС могут являться молекулы (p)ppGpp (сигнальные молекулы стресса, которые инициируют и регулируют образование биопленок, переход клеток в персистирующее состояние и ряд других адаптационных реакций). Эта активность очевидно лежит в основе способности ГС эффективно ингибировать бактериальную стрессовую реакцию и препятствовать формированию биопленок, а также вызывать киллинг клеток-персистеров [28].
По механизму действия в целом ряде аспектов — влияние на биосинтез и целостность клеточной мембраны, изменение мембранного потенциала, делокализация белка MinD-GFP, активация быстрой потери калия, индукция белков-маркеров мембранного стресса LiaH и TrmB — ГС схож с низином (бактериоцин, продуцируемый стрептококками группы N, такими как Lactobacillus lactis), а также с рядом бактериоцинов I и II классов нормобиоты полости рта, в частности с циклическим бактериоцином 1B класса, вырабатываемым Lactobacillus acidophilus [34, 35]. В связи с такой функциональной близостью ГС может позитивно взаимодействовать не только с нормальной микрофлорой ротоглотки, но и с факторами местной неспецифической защиты [36].
Крайне высокая протеолитическая стабильность, а также множественные механизмы бактерицидного действия, включая выраженную мембранотропность, могут обусловливать практическое отсутствие случаев выявления у микроорганизмов приобретенной резистентности в отношении ГС в клинической практике вплоть до настоящего времени [24, 28, 37].
Полученные в условиях in vitro в ходе целенаправленного эксперимента с применением искусственной индукции, лабораторные штаммы Staphylococcus aureus 209P со сниженной чувствительностью к ГС сохраняли чувствительность к другим антибактериальным препаратам, но обладали пониженной на 30% дыхательной активностью и жизнеспособностью [38]. В отличие от ГС, в отношении других антимикробных пептидов, входящих в состав безрецептурных препаратов для лечения боли в горле (линейный грамицидин А, бацитрацин и тиротрицин), в ходе экспериментов по формированию устойчивости было продемонстрировано стабильно сохраняющееся после прекращения действия пептидов увеличение минимальной подавляющей концентрации (МПК) в отношении ряда микроорганизмов. Одновременно с возникновением устойчивости к данным пептидам у бактерий сформировалась приобретенная перекрестная устойчивость к классическим противомикробным препаратам (ципрофлоксацин, фузидиевая кислота, гентамицин, цефподоксим, амоксициллин / клавулановая кислота и цефотаксим) [39], что ставит вопрос о пересмотре перспективности этих пептидов в топической этиотропной терапии.
Согласно данным, опубликованным за последние 40 лет, показана высокая бактерицидная активность ГС в отношении грамотрицательных бактерий, включая Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae и др., с МПК в диапазоне 4–64 мкг/мл. Более активен ГС в отношении грамположительных патогенных микроорганизмов. Например, МПК в отношении Staphylococcus aureus, включая штаммы, устойчивые к метициллину (MRSA), начиная с 1981 г. стабильно сохраняется на уровне, не превышающем 8 мкг/мл [40–42]. По данным S. Derbal et al. [43], ГС в концентрации <10 мкг/мл подавляет рост стрептококков (БГСА-штамм 5448 и ряд других стрептококков).
В проведенном с участием одного из авторов в октябре — декабре 2021 г. исследовании МПК ГС в отношении Staphylococcus aureus не превышала 8 мкг/мл, в том числе у клинических изолятов, характеризующихся множественной резистентностью в отношении нескольких групп классических антимикробных препаратов для системного действия (группы β-лактамов, макролидов, респираторных фторхинолонов, тетрациклинов, аминогликозидов и др.), что позволяет в очередной раз сделать вывод об отсутствии у данного патогена устойчивости к ГС [44]. Уровень МПК ГС в отношении всех тестовых патогенов не превышал концентрацию, содержащуюся в широко применяемых в клинической практике лекарственных препаратах (линия Граммидин® (URL: https://grls.rosminzdrav.ru/grls.aspx?s=%D0%B3%D1%80%D0%B0%D0%BC%D0%BC%D0%B8%D0%B4%D0%B8%D0%BD&m=tn)…. МПК ГС в отношении Streptococcus pneumoniaе, включая штамм, резистентный к оксациллину и эритромицину, не превышала 16 мкг/мл.
Исследование показало, что различие между МПК и минимальной бактерицидной концентрацией (МБК, концентрация, вызывающая полную гибель бактериальных клеток) ГС в отношении исследуемых клинических изолятов патогенов не превышало 8 раз, что также отражает высокий потенциал бактерицидного действия.
Дополнительно проводили эксперимент, имевший задачей моделирование курсового воздействия ГС, приближенное к применению вещества в составе лекарственных препаратов в клинической практике (7-дневное применение в разовой дозе 1600–3200 мкг по 3–4 раза в сутки согласно инструкции по медицинскому применению препаратов линии Граммидин®). В данном эксперименте изучали влияние ГС на тестовые патогены в подавляющих и субподавляющих концентрациях (концентрации меньше МПК отражают реальные концентрации, создаваемые при клиническом применении в ротовой полости, а также используются в экспериментах по целенаправленному формированию резистентности микроорганизмов к противомикробным средствам в лабораторных условиях) на плотных и жидких средах. Результаты эксперимента показали, что при многократном ежедневном воздействии ГС на исследуемые микроорганизмы характеристики антимикробной активности ГС (МПК и МБК) не повышались на всем протяжении эксперимента (7 пассажей на плотных и жидких средах). Таким образом, результаты исследования продемонстрировали высокую бактерицидную активность ГС в отношении ведущих возбудителей респираторных инфекций, а в ходе многократного воздействия ГС на патогены, включая обладающие устойчивостью к широко применяемым системным антибиотикам и противомикробным средствам, не было выявлено признаков формирования у них резистентности [44].
Как указывалось выше, в случаях отсутствия показаний к системному назначению противомикробных препаратов в клинической практике широко применяется местная терапия, что нашло отражение в актуальных клинических рекомендациях [9]. Целью назначения местных препаратов являются подавление активности возбудителей инфекции, быстрое достижение противовоспалительного и болеутоляющего эффектов, а также профилактика вторичного инфицирования поврежденной слизистой оболочки глотки при благоприятном профиле безопасности препарата [9]. Вместе с тем в клинических рекомендациях отмечается наличие нежелательных эффектов и риска развития аллергических реакций, присущих некоторым из данных препаратов, например содержащим хлоргексидин и соединения йода [9]. Кроме того, не для всех местных противомикробных и антисептических средств понятны степень и характер их влияния на нормальную микробиоту, что является актуальным аспектом в настоящее время [9].
С учетом всех рассмотренных выше аспектов (широта спектра действия, выраженность терапевтического эффекта противомикробных препаратов, преодоление рисков развития антибиотикорезистентности, а также влияние на местные факторы защиты, включая нормальную микробиоту ротоглотки) наибольшую эффективность при применении топических препаратов можно достичь благодаря комбинированному воздействию нескольких синергично действующих компонентов [45]. Так, помимо топического применения антимикробных пептидов, перспективным может считаться местное использование препаратов, обладающих антисептическими свойствами, которое обеспечит более устойчивое воздействие на широкий спектр возбудителей заболевания [9].
Цетилпиридиния хлорид
К антисептическим средствам, разрешенным для топического применения у детей и взрослых, относится цетилпиридиния хлорид (ЦПХ) — четвертичное аммониевое соединение, широко известное с 1946 г. [46]. В исследованиях in vitro и in vivo продемонстрированы безопасность и эффективность применения ЦПХ в полости рта и в глотке [35, 47]. Механизм действия ЦПХ основан на дезинтеграции липидных мембран грамположительных и грамотрицательных патогенных и условно-патогенных бактерий ротовой полости, таких как Staphylococcus aureus, включая MRSA, Streptococcus sanguinis, Pseudomonas aeruginosa, а также грибов Candida albicans и Aspergillus niger. Кроме того, ЦПХ препятствует созданию биопленок патогенной микробиоты в полости рта и глотке и проявляет высокую активность в отношении мультимикробных биопленок [48]. Лабораторные исследования влияния антисептиков на микробиоту показали, что ЦПХ оказывал наиболее щадящее воздействие на индигенные микроорганизмы (представители нормальной микробиоты) [49]. Клиническое исследование группы профессора J.R. Radford et al. [50] продемонстрировало отсутствие нарушений нормобиоты полости рта при применении 0,05% раствора ЦПХ 2 раза в день в течение 6 нед. у здоровых добровольцев. Помимо этого, согласно результатам исследований, опубликованных за последние 10 лет, ЦПХ проявляет противовирусную активность в отношении респираторных вирусов (вирусы гриппа А и B, парагриппа, респираторно-синцитиальный вирус, коронавирусы SARS-COV-2, MERS-CoV, MHV-A59 и HCoV-NL63) [47, 51, 52].
Комбинация грамицидина С и ЦПХ широко применяется в клинической практике в двух лекарственных формах для топической терапии боли в горле (линия препаратов Граммидин®). Эффективность и безопасность препаратов в форме спрея подтверждены у взрослых и детей в возрасте с 3 лет [35, 53] и в форме таблеток для рассасывания у детей в возрасте 4 года и старше [54, 55].
Известно, что вирусы, обладающие тропностью к эпителию слизистой оболочки носо- и ротоглотки, а также бактериальные патогены и вирусно-бактериальные ассоциации в процессе развития инфекционного воспаления приводят к выраженным изменениям нормобиоты — одного из важнейших физиологических барьеров и звеньев неспецифической резистентности организма человека в верхних отделах дыхательного и пищеварительного трактов [56].
Возвращаясь к одному из очень важных аспектов, затронутых в статье, следует отметить, что состав и функциональная активность нормальной микробиоты играют ключевую роль в функционировании системы местной резистентности. Нарушение колонизационной резистентности слизистой оболочки респираторного тракта в результате воздействия вирусных и бактериальных возбудителей респираторных инфекций приводит к более легкому развитию указанных инфекций, выраженному длительному и рецидивирующему характеру их течения [57]. В связи с этим при выборе препаратов для топической этиотропной терапии инфекционно-воспалительных заболеваний верхних дыхательных путей целесообразно использовать сценарий биоценозсберегающей терапии [58, 59].
Заключение
Проблема адекватной терапии острых инфекционно-воспалительных заболеваний верхних дыхательных путей, сопровождающихся болью в горле, остается актуальной, несмотря на многочисленные исследования, имеющиеся авторитетные клинические рекомендации и алгоритмы диагностики и терапии.
Актуальность этой темы определяется не только высокой распространенностью данной группы заболеваний среди населения практически всех возрастов — важнейшими аспектами являются выбор терапевтической стратегии с учетом потребностей пациентов, а также последствия антимикробной терапии в виде роста антибиотикорезистентности и снижения колонизационной резистентности слизистой оболочки с развитием дисбиотических изменений.
В настоящее время, с одной стороны, отмечается необоснованно широкое применение практикующими специалистами системных антибактериальных препаратов с указанными выше последствиями, с другой стороны, имеются отдаленные перспективы по внедрению системных узконаправленных противомикробных агентов и формированию по сути новой парадигмы противомикробной терапии в целом. Вместе с тем уже в настоящее время существует вполне реальная возможность решения имеющихся проблем — использование топических комбинированных препаратов, компоненты которых оказывают синергичное этиотропное действие и вместе с тем существенно снижают риск формирования устойчивости микроорганизмов при щадящем влиянии на функционирование нормальной микробиоты ротоглотки, которая является ключевым звеном системы резистентности организма человека.
Сведения об авторах:
Радциг Елена Юрьевна — д.м.н., профессор, профессор кафедры оториноларингологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4613-922X.
Гуров Александр Владимирович — д.м.н., профессор кафедры оториноларингологии лечебного факультета, профессор кафедры микробиологии и вирусологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; старший научный сотрудник отдела эпидемиологии, клинических исследований и научного прогнозирования ГБУЗ НИКИО им. Л.И. Свержевского ДЗМ; 117152, Россия, г. Москва, Загородное ш., д. 18а, стр. 2; ORCID iD 0000-0001-9811-8397.
Контактная информация: Радциг Елена Юрьевна, e-mail: radtsig_e@rsmu.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: А.В. Гуров сообщил о получении гранта на проведение независимого экспертного анализа результатов доклинического изучения антимикробной активности грамицидина С в отношении ведущих возбудителей респираторных инфекций, которое по заказу АО «Валента Фарм» в рамках осуществления текущего плана научных работ компании было выполнено независимой исследовательской организацией АО «НПО «Дом фармации».
Статья поступила 09.07.2022.
Поступила после рецензирования 02.08.2022.
Принята в печать 25.08.2022.
About the authors:
Elena Yu. Radtsig — Dr. Sc. (Med.), Professor, Professor of the Department of Otorhinolaryngology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-4613-922X.
Aleksandr V. Gurov — Dr. Sc. (Med.), Professor of the Department of Otorhinolaryngology, Professor of the Department of Microbiology and Virology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; senior researcher of the Division of Epidemiology, Clinical Trials and Prognostic Research, L.I. Sverzhevskiy Research Clinical Institute of Otorhinolaryngology; 18A Build. 2, Zagorodnoe road, Moscow, 117152, Russian Federation; ORCID iD 0000-0001-9811-8397.
Contact information: Elena Yu. Radtsig, e-mail: radtsig_e@rsmu.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interests: A.V. Gurov informed that he has received a grant for performing an independent panel review of the results of the pre-clinical study of Gramycidin S antimicrobial activity against the most prevalent pathogens causing respiratory infections. The study was conducted upon request of AO Valenta Pharm within the implementation of the current plan of company’s research activities by an independent research organization AO NPO «Home of Pharmacy».
Received 09.07.2022.
Revised 02.08.2022.
Accepted 25.08.2022.
Боль в горле — это болезненные ощущения в области глотки и гортани, которые зачастую усиливаются при разговоре и глотании. Выделяют различные причины, приводящие к болям в горле: вирусные и бактериальные заболевания глотки, аллергические реакции и опухолевые процессы, гиповитаминозы. Для выявления этиологического фактора осуществляется инструментальный осмотр дыхательных путей, рентгенография, УЗИ, бактериологические и серологические реакции. Для купирования боли, которая возникла в горле, используют теплое щелочное питье, полоскания, физиотерапевтические процедуры.
Причины боли в горле
Внешние факторы
Частные причины появления чувства жжения, першения в ротоглотке, реже гортани — длительное пребывание в комнате с низкой влажностью воздуха или условиях сухого жаркого климата. Отмечается сухость слизистых оболочек, нехватка слюны. Боли сильнее ощущаются в горле при разговоре, употреблении твердой пищи. Особенно интенсивен дискомфорт после пробуждения – из-за приоткрытости рта во сне слизистые еще больше пересыхают. У мужчин болезненность провоцируется храпом. Пациенты сообщают, что с утра горло болит и больно разговаривать, а для облегчения состояния нужно выпить воды.
Горло может сильно болеть при вдыхании загрязненного воздуха — в шахтах, при работе в песчаных карьерах, в больших городах вследствие воздействия выхлопных газов. Симптом возникает внезапно при выходе на улицу или попадании в промышленные помещения. Болезненность сопровождается сухим надсадным кашлем. Периодическое и кратковременное появление подобных признаков — вариант нормы. Если неприятные ощущения беспокоят человека длительное время, мешают принимать пищу или разговаривать, необходимо обратиться к специалисту, чтобы выяснить причины, почему болит горло.
Вирусные заболевания
Сильная боль в горле характерна для многих респираторных инфекций, которые повреждают слизистые оболочки глотки, гортани. Причины болезненности — прямое патогенное влияние на эпителий, системное действие возбудителя, поражение нервных окончаний. В большинстве случаев симптом возникает на фоне высокой температуры тела, слабости, признаков интоксикации. Чаще всего боль в горле провоцируют:
- Вирусный фарингит. Вначале появляется дискомфорт, чувство саднения, першения в глоточной области, постепенно сменяющееся сильными болями в проекции горла, мучительным сухим кашлем. Для фарингита типичен симптом «пустого глотка» — неприятные ощущения усиливаются при проглатывании слюны.
- Инфекционный мононуклеоз. При действии этой причины у человека сильно болит горло, прием пищи практически невозможен, некоторые пациенты отказываются даже от воды. Одновременно с проявлением болевых ощущений увеличиваются и воспаляются регионарные лимфоузлы.
- Аденовирусная инфекция. Горло обычно начинает болеть через день-два после начала насморка и слезотечения. Боли умеренные, усиливаются при глотании и разговорах. Пациенты зачастую замечают точечный белесоватый налет на миндалинах, позже присоединяется лающий кашель.
- Герпетический процесс. В горле болит при развитии специфического осложнения — герпангины. Болезненность отмечается на фоне увеличения температуры до 39-40 градусов. На слизистой зева видны сероватые пузырьки, при вскрытии которых болевой синдром усиливается.
Боль в горле
Бактериальные инфекции
Если болит горло и больно глотать, это может служить признаком ангины (тонзиллита). Сначала возникает дискомфорт и першение в глотке, сменяющиеся на резкую боль. Болевые ощущения иррадиируют в ухо, шею, затылок. Иногда пациенты сами замечают увеличение и покраснение миндалин, формирование на них точечных гнойничков. Симптомы протекают на фоне фебрильной лихорадки, общей слабости, артралгий и миалгий. Если боли в горле усиливаются вплоть до невозможности глотать даже воду, возможно, формируется интратонзиллярный абсцесс (флегмонозная ангина).
Когда болит горло у детей, и боли сопровождаются нарушениями дыхания, можно предположить эпиглоттит — воспаление надгортанника. Из-за интенсивного болевого синдрома ребенок отказывается от пищи и воды, в течение нескольких часов нарастают явления дисфагии. Для уменьшения дискомфортных ощущений и облегчения дыхания больные принимают вынужденную позу: сидят, наклонившись вперед, сильно вытягивают шею и немного приоткрывают рот. Боль в горле, локализованная с одной стороны и возникающая на фоне выраженной лихорадки, является признаком заглоточного абсцесса.
Ларингиты
При остром ларингите горло зачастую начинает болеть одновременно с повышением температуры до субфебрильных значений, появлением слабости. Болевые ощущения сильные, при локализации воспаления по задней стенке органа болезненность усиливается во время глотания. Симптом сочетается с резким лающим кашлем без выделения мокроты, при вовлечении в процесс голосовых связок временно исчезает голос. Для хронических ларингитов характерна незначительная боль в горле, на первый план выходит быстрая утомляемость и изменение тембра голоса, постоянная охриплость.
Кандидоз полости рта
При грибковых поражениях полости рта и глотки постоянно болит горло, интенсивность болевых ощущений значительно усиливается при попытке приема пищи. На слизистых оболочках видны массивные белые налеты, также кандидоз вызывает трещины и болезненные заеды в углах губ. Размножение грибковой флоры наблюдается у людей со сниженным иммунитетом: после трансплантации органов, при онкологических болезнях, вторичных иммунодефицитах. В таких случаях процесс может распространяться на все дыхательные пути, вызывая соответствующие симптомы.
Аллергии
При аллергических фарингитах и ларинготрахеитах в горле возникает боль средней интенсивности, вызванная воздействием триггерного фактора. Внезапно в глотке начинает саднить и першить. Состояние сопровождается приступами поверхностного сухого кашля, не приносящего облегчения. Возможно чихание, обильное слезотечение и зуд. Склонные к аллергии люди сообщают, что горло у них может болеть после вдыхания запаха цветов, контакта со средствами бытовой химии или косметикой. Симптом также встречается после употребления определенных продуктов.
Инородные тела глотки
При случайном проглатывании рыбных или мясных костей они могут застрять в горле и вызвать резкие боли. Болевые ощущения колющего или режущего характера чаще имеют четкую локализацию. Проявление сочетается с сильным безрезультатным кашлем, иногда наблюдается покраснение и отечность лица из-за мучительных кашлевых пароксизмов. Человек начинает задыхаться. У детей горло может болеть в случае попадания в дыхательные пути мелких деталей от игрушек. При инородных телах глотки требуется неотложная медицинская помощь.
Гастроэзофагеальный рефлюкс
У взрослых возможные причины, при которых также болит горло, — это периодические забросы в глотку и дыхательные пути кислого содержимого из желудка при ГЭРБ. Интенсивность болей неодинакова в течение дня: сильный болевой синдром наблюдается утром после сна, потому что горизонтальное положение способствует затеканию кислоты в глотку. Боль в горле сочетается с надсадным сухим кашлем, постоянным чувством першения и дискомфорта. Также больные сообщают, что их беспокоит кислая отрыжка и приступы изжоги. Эти симптомы типичны для гиперацидных гастритов, язв ЖКТ, эзофагитов.
Дефицитные состояния
Для нормальной регенерации слизистой оболочки глотки необходимо присутствие многих биологически активных веществ и витаминов. При несбалансированном питании или поражении ЖКТ, сопровождающихся нарушениями всасывания компонентов пиши, могут развиваться авитаминозы, одним из проявлений которых является боль в горле. Вероятные причины болевых ощущений — такие дефицитные состояния, как:
- Гиповитаминоз В2. Пациенты жалуются, что горло жжет и болит при разговорах, приеме пищи. Формируются болезненные трещины в уголках губ (ангулярный хейлит) и воспаление языка.
- Гиповитаминоз В12. Ощущаются жгучие боли в языке и горле, при этом язык ярко-красный и блестящий. Больные могут жаловаться на онемение и парестезии в нижних конечностях.
- Гиповитаминоз С. При нехватке аскорбиновой кислоты боль в горле связана с язвенными дефектами слизистых оболочек. Пациенты сообщают о металлическом привкусе во рту, кровоточивости десен.
Хронические заболевания
Поражение внутренних органов сопровождается накоплением в крови токсических метаболитов и азотистых продуктов обмена веществ. Боль, воспринимаемая как дискомфорт в горле, обусловлена хроническим воспалением и атрофическими процессами в глотке. Болевые ощущения могут провоцироваться повышением уровня глюкозы в крови, что сочетается с сухостью во рту и катаральными процессами. Горло зачастую может болеть при следующих соматических заболеваниях:
- Болезни внутренних органов: ХПН, поражение печени.
- Эндокринная патология: сахарный диабет, синдром Иценко-Кушинга, гипотиреоз.
Опухоли
Длительная боль в горле с нарушениями глотания, которые не поддаются стандартной консервативной терапии, может быть признаком разрастания новообразований в области гортаноглотки. При доброкачественных опухолях пациенты жалуются на постоянное чувство давления и распирания, бывает поперхивание во время еды. Резкая боль в шее и горле, сопровождающаяся кровохарканием, может свидетельствовать о развитии рака глотки или гортани как основной причины появления болезненности. Также пациент замечает постепенную потерю голоса, охриплость, наблюдается периодическое сухое покашливание.
Осложнения фармакотерапии
Частые причины, провоцирующие боли в горле — длительный прием некоторых препаратов. При закапывании сосудосуживающих капель для носа лекарство стекает по задней поверхности глотки, вызывая хроническое раздражение и воспаление в слизистой оболочке. Больные отмечают постоянное чувство першения и жжения, бывает сухой кашель. Горло также может болеть по окончании длительного приема глюкокортикостероидов или антибактериальных препаратов, которые провоцируют снижение местного иммунитета. Человек жалуется на сухость во рту, усиление болевых ощущений при разговоре.
Редкие причины
- Ксеростомия.
- Одонтогенный процесс: периодонтит, гальванизм, патология прорезывания зубов.
- Болезни сердца: нестабильная стенокардия, атипичная форма инфаркта миокарда.
- Патология смежных органов: глоточно-пищеводные (ценкеровские свищи), заболевания щитовидной железы.
- Поражения нервов: невроз глотки, невралгия языкоглоточного нерва.
- Поражение позвоночника: шейный остеохондроз, туберкулезный спондилит, радикулит.
- Шилоподъязычный синдром Игла-Стерлинга.
Диагностика
Выяснением причины, которая спровоцировала боль в горле, занимается врач-отоларинголог. Диагностический поиск предполагает комплексное обследование ротовой полости и дыхательных путей с помощью инструментальных и лабораторных методов, при наличии сопутствующей симптоматики проводится визуализация органов грудной и брюшной полостей. Наиболее информативными для диагностики острых болей в горле считаются следующие методы:
- Инструментальный осмотр. Для детального изучения состояния органов дыхательной системы эффективна фарингоскопия, непрямая ларингоскопия. Для исключения отогенной причины болей в горле выполняется отоскопия. Во время исследования оценивается внешний вид слизистых оболочек, наличие налета и очагов изъязвления.
- Бактериологический анализ. Для бакпосева берут мазок из зева, мокроту или образцы налета. Метод необходим для подтверждения наиболее распространенных болезней, сопровождающихся резкой болью в горле — ангины, вирусного или бактериального фарингита. Экспресс-диагностика включает РИФ смывов из глотки.
- Сонография. При острых болях в шее, горле, которые наблюдаются длительное время, необходимо ультразвуковое исследование для исключения патологии смежных органов. Метод позволяет выявить локальные скопления гноя в окологлоточной клетчатке, наличие кист и объемных образований. Также обязательно назначают УЗИ щитовидной железы.
- Рентгенологическое обследование. Если сильно болит в области шеи и горла, показана рентгенография гортани для исключения опухолевого процесса. Для детальной визуализации рекомендована КТ гортани. В отдельных случаях производится радиоизотопное сканирование щитовидной железы.
- Лабораторные исследования. Больным, которые ощущают боль в горле, назначают стандартный клинический и биохимический анализ крови, измеряют концентрацию глюкозы натощак. Для исключения хронических заболеваний по показаниям делают печеночные пробы, определяют острофазовые показатели и уровень некоторых ферментов.
Для выявления эндокринной патологии как ведущей причины болей необходимо исследование крови на гормоны щитовидной железы и коры надпочечников. Серологические реакции (РИФ, ИФА, ПЦР) нужны для идентификации патогенных микроорганизмов. Дополнительно могут делать рентгенографию и КТ шейного отдела позвоночника. При наличии диспепсических расстройств применяются ФГДС и внутрипищеводная рН-метрия. Пациенты, у которых болит горло, должны быть осмотрены стоматологом на предмет наличия воспалительных процессов зубов и периодонта.
Осмотр горла
Лечение
Помощь до постановки диагноза
Чтобы уменьшить боль в горле, рекомендовано обильное теплое питье (чаи, травяные отвары), при этом желательно исключить напитки с молоком. Можно полоскать ротоглотку настойкой календулы, принимать таблетки для рассасывания. Врачи советуют избегать резких запахов, ограничить использование бытовой химии, которая может раздражать слизистую. При интенсивных болях нужно принимать теплую, химически и механически щадящую пищу — супы, каши. Если горло очень болит или боль сопровождается лихорадкой, слабостью, необходимо в кратчайшие сроки обратиться к врачу.
Консервативная терапия
Врачебная тактика зависит от причины появления болей в горле. Наиболее эффективна этиотропная терапия. Быстро снизить боль в горле помогает комбинация медикаментозного лечения с физиотерапевтическими методами, которые направлены на устранение основной причины расстройства и отдельных болезненных проявлений. Помимо полосканий часто применяют ингаляции с эфирными маслами и лекарственными растворами. Проводят УВЧ на область глотки, магнито- и лазеротерапию. Схемы лечения включают:
- Антибиотики. Если горло болит из-за инфекционного процесса, используются антибактериальные средства, которые избирательно действуют на возбудителей респираторных инфекций. При кандидозе назначают прием специфических противогрибковых препаратов.
- Противовоспалительные средства. Купировать боль в горле позволяют препараты из группы НПВС. Медикаменты эффективно снижают уровень воспалительных медиаторов и цитокинов, обладают мощным жаропонижающим и болеутоляющими эффектами.
- Антисептики. Показаны бактерицидные средства (хлоргексидин и др.), которые подавляют рост бактериальной флоры в глотке и дыхательных путях. Для купирования болей горло дополнительно полощут мятой, эвкалиптом, другими натур-продуктами по нескольку раз в день.
- Антигистаминные препараты. Когда горло начинает болеть после контакта с аллергенами, необходим пероральный прием специфических препаратов — блокаторов гистаминовых рецепторов. В тяжелых ситуациях эффективны аэрозоли с топическими кортикостероидами.
- Витамины. Боль в горле может возникать из-за сильного недостатка витаминов, поэтому после сдачи специфических анализов необходимо принимать витаминные препараты с учетом непосредственной причины авитаминоза. Чаще всего рекомендованы лекарственные средства на основе цианокобаламина, рибофлавина.
- Инфузионные составы. При обширных гнойных процессах боли, ощущаемые в горле, сопровождается массивной интоксикацией организма, для устранения которой применяются кристаллоидные и коллоидные растворы, вводимые внутривенно через капельницу.
- Антисекреторные препараты. Боль в горле, вызванная гастроэзофагеальным рефлюксом, требует приема медикаментов, снижающих кислотность. Препараты выбора — ингибиторы протонной помпы, которые отличаются минимальными побочными эффектами.
Хирургическое лечение
Боль в горле, которая развилась вследствие гнойных процессов (заглоточного или паратонзиллярного абсцесса, нагноения кисты), требует проведения оперативного вмешательства для устранения ведущей причины. Производится разрез и дренирование гнойника, его промывание антибактериальными и антисептическими растворами. При доброкачественных неоплазиях делают экономную резекцию глотки. Злокачественные образования, при которых предъявляются жалобы на боль в горле, требуют выполнения гемиларингэктомии с формированием трахеостомы. В отдаленном периоде по возможности выполняют ларингопластику.
Практически любое инфекционно-воспалительное заболевание верхних дыхательных путей, как правило, сопровождается болью в горле различной интенсивности. Однако данный симптом не всегда является следствием простуды и может появляться и при других заболеваниях. Установить, что поводом для беспокойства ребенка является именно боль в горле, помогают такие симптомы, как отказ ребенка от еды, питья, появление шумного сглатывания, напряжение мышц грудной клетки во время глотка.
Для эффективного и успешного лечения любого заболевания основным определяющим фактором является максимально точ …
Для доступа к полному тексту материала, пожалуйста, авторизуйтесь или
зарегистрируйтесь